1.阴道加德纳菌(Gardnerella vaginalis)
物种名:阴道加德纳菌
拉丁学名:Gardnerella vaginalis
分类学地位:细菌界Bacteria;放线菌门Actinobacteria;
放线菌纲 Actinobacteria;双歧杆菌目Bifidobacterial;
双歧杆菌科Bifidobacteriaceae;加德纳氏菌属Gardnerella
阴道加德纳菌最早由Gardner和Dukes于1953年从患有非特异性阴道炎的女性中分离出来,并命名为阴道嗜血杆菌。最初,这种细菌被认为与其他阴道嗜血杆菌属细菌相似。然而,随后的研究表明,阴道加德纳菌与阴道嗜血杆菌属的其他成员之间没有密切的遗传关系。因此,Greenwood和Pickett于1980年将其重新分类到一个新的属,即加德纳氏菌属,并重新命名为阴道加德纳菌。
1.1生物学特性
1.1.1 培养特征
阴道加德纳菌可以在多种培养基上生长,包括血琼脂、巧克力琼脂和磷酸盐缓冲盐水琼脂。在血琼脂上,阴道加德纳菌通常表现为β溶血性,即在琼脂上形成透明的溶血环(图1)。阴道加德纳菌的菌落通常呈现灰白色或透明色,表面光滑,并且通常在厌氧条件下生长良好。该菌对多种抗生素敏感,包括甲硝唑和克林霉素[1]。
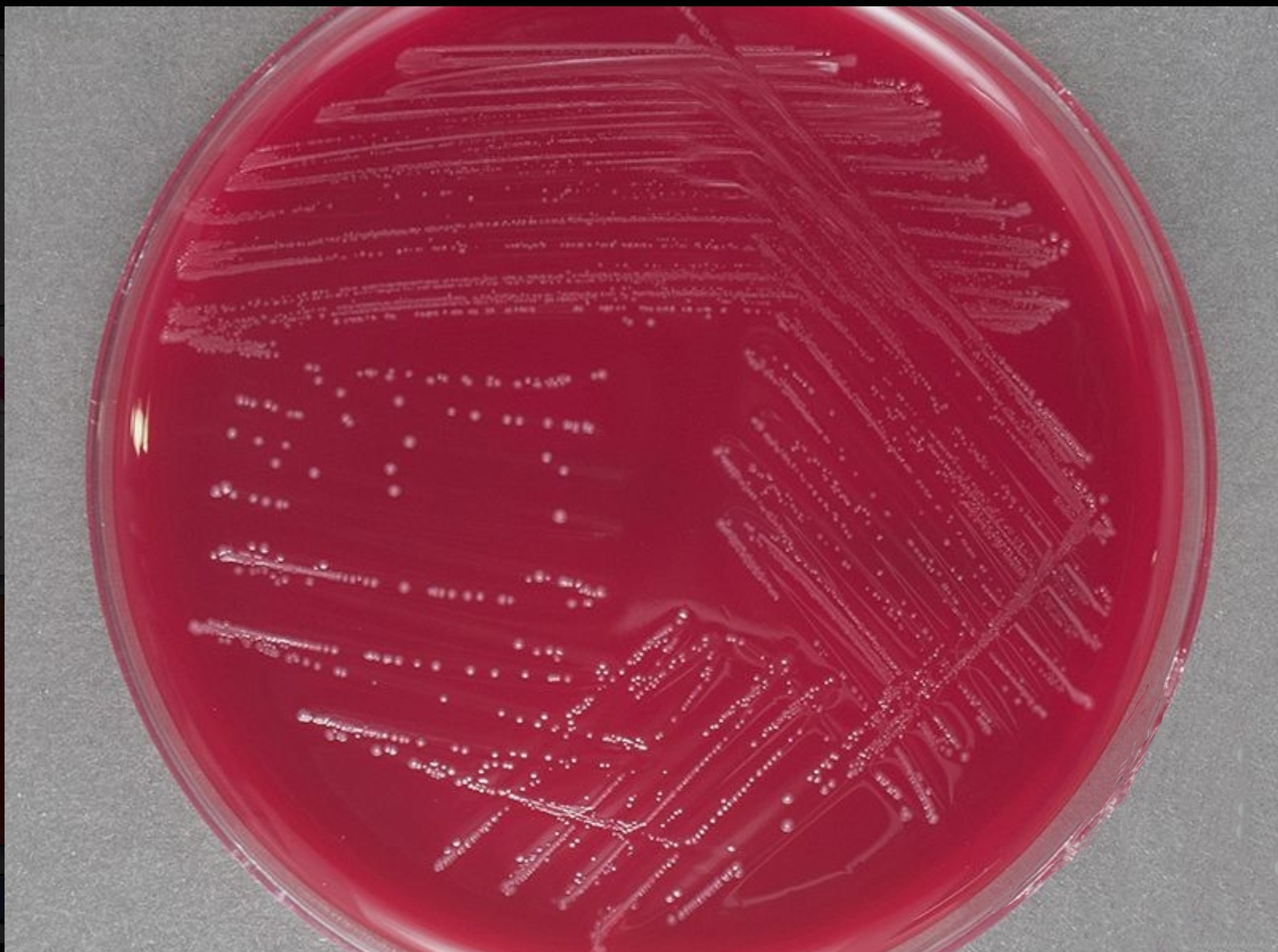
图1 阴道加德纳菌在血平板上的菌落形态
1.1.2 形态学特征
阴道加德纳菌是一种小型的革兰氏染色可变细菌,通常呈现为短杆状或球状。其细胞形态在显微镜下通常表现为1-2 μm的杆状体。尽管该菌的革兰氏染色特性在不同条件下可能变化,但它的细胞壁结构是由一层薄的肽聚糖层组成,这使得它在某些情况下表现为革兰氏阳性,而在其他情况下表现为革兰氏阴性[2]。这种染色的可变性可能与其在宿主体内的生存策略有关,允许其在不同的环境条件下适应和生存。阴道加德纳菌光学显微镜下的形态特征见图2。
图2 阴道加德纳菌光学显微镜下的形态特征
1.1.3 生化特征
在生化方面,阴道加德纳菌显示出一系列特征性的酶活性。它不产生过氧化氢酶和氧化酶,但能够水解淀粉、脂肪酶,并且通常表现出β-半乳糖苷酶活性。该菌能够发酵多种碳水化合物,包括葡萄糖和麦芽糖,但不发酵甘露醇。此外,阴道加德纳菌在氢化酶、脂酶和半乳糖酶测试中通常呈现阳性结果,这些生化反应有助于在实验室中对该菌进行鉴定和分型[3]。此外,阴道加德纳菌的生化特征还表现为能够分解肽类化合物并产生挥发性脂肪酸,这些代谢产物可能在其致病机制中发挥重要作用。
1.1.4 分子生物学特征
近年来,随着基因组学技术的发展,对阴道加德纳菌的分子生物学特征的研究取得了重要进展。基因组分析显示,阴道加德纳菌存在显著的遗传多样性,表现为多个基因型或基因簇。这些基因型在不同的生态环境中表现出不同的致病性和适应性。例如,Tarracchini等[4](2020)的研究发现,阴道加德纳菌的基因组可以分为多个不同的基因型,每个基因型都具有独特的基因组结构和代谢潜力。这种遗传多样性可能与阴道加德纳菌在不同宿主中的致病性差异有关。
此外,阴道加德纳菌基因组中还存在大量的可移动遗传元件,如质粒和转座子,这些元件可能通过水平基因转移促进了该菌的遗传多样性和适应性。基因组分析还揭示了一些与致病性相关的基因,如编码细胞溶素(vaginolysin)、生物膜形成、铁摄取和抗生素耐药性相关的基因。这些基因的存在表明,阴道加德纳菌可能具有多种潜在的致病机制,能够在不同的宿主和环境中发挥作用[5]。
1.2分布、传播与致病性
1.2.1 分布与传播
阴道加德纳菌广泛存在于人类的阴道微生物群落中,是阴道生态系统的重要组成部分。虽然它可以在健康女性的阴道中找到,但其浓度通常较低。然而,在患有细菌性阴道病(BV)的女性中,阴道加德纳菌的浓度显著增加,且通常伴随着乳酸杆菌数量的减少[6]。阴道加德纳菌主要通过性传播或自体传播在宿主内传播。研究表明,阴道加德纳菌 的不同基因型可能通过性接触或阴道-肛门接触传播,尤其是在多性伴侣之间传播的风险更高。
1.2.2 致病性
阴道加德纳菌是细菌性阴道病(BV)的主要病原体之一。BV是一种常见的阴道感染性疾病,表现为阴道分泌物增多、异味、灼热感等症状。阴道加德纳菌的致病性与其在阴道内的过度生长有关,这会导致阴道内正常微生物群的失衡,尤其是乳酸杆菌的减少,从而引发BV。阴道加德纳菌通过多种机制发挥其致病作用,包括破坏阴道上皮细胞的屏障功能、诱导炎症反应以及形成生物膜等[7]。此外,不同基因型的阴道加德纳菌可能具有不同的致病潜力,部分基因型与更严重的BV相关。
研究表明,阴道加德纳菌的部分基因型具有更高的黏附能力和毒力因子表达,如细胞溶素(vaginolysin)和黏蛋白酶(sialidase)。这些毒力因子有助于阴道加德纳菌在阴道上皮细胞上的黏附和侵袭,并通过分解黏蛋白破坏阴道上皮的防御屏障。此外,阴道加德纳菌还能够形成生物膜,这种生物膜不仅有助于菌体的定植,还能够保护菌体免受宿主免疫系统和抗生素的攻击,从而增加其致病性和抗药性[5]。
1.3 检测方法
阴道加德纳菌的检测方法主要包括传统的培养方法、生化鉴定方法和现代的分子生物学技术。传统的培养方法通常使用选择性培养基,如人血琼脂和巧克力琼脂,通过观察菌落形态和溶血现象进行初步鉴定。生化鉴定方法则依赖于阴道加德纳菌的特征性酶活性,如β-半乳糖苷酶、脂肪酶和淀粉酶活性,这些生化反应可以在实验室中进行快速检测[3]。
随着分子生物学技术的发展,定量PCR(qPCR)已成为检测阴道加德纳菌的主要方法之一。qPCR方法不仅能够快速准确地检测阴道加德纳菌的存在,还能够区分其不同的基因型和亚型。例如,Balashov等(2014)的研究开发了一种基于qPCR的分型方法,能够有效区分与BV相关的阴道加德纳菌致病性基因型和健康女性中的非致病性基因型[8]。此外,16S rRNA 基因测序和cpn60 基因测序也是常用的分子生物学方法,用于研究阴道加德纳菌的基因多样性和进化关系。这些方法可以提供更高分辨率的鉴定结果,有助于深入研究阴道加德纳菌的致病机制和流行病学特征。
1.4 典型案例
临床研究表明,阴道加德纳菌是引发细菌性阴道病(BV)的主要病原体之一。BV 是一种常见的女性生殖道感染性疾病,通常表现为阴道分泌物增多、异味、阴道不适等症状。阴道加德纳菌通过破坏阴道内的乳酸杆菌平衡,引发炎症反应和pH值升高,导致BV的发生。
例如,Schellenberg等[9](2017)的研究发现,在一项对来自加拿大、比利时和肯尼亚的女性进行的多中心研究中,阴道加德纳菌的不同基因型在BV患者和健康女性中存在显著差异。BV患者中,阴道加德纳菌的致病性基因型(如sialidase阳性基因型)比例显著增加,而这些基因型通常与更严重的临床症状相关。此外,该研究还表明,BV患者的阴道加德纳菌 基因型多样性较健康女性更高,表明多基因型感染可能与BV的发生密切相关。
1.5 防治对策
阴道加德纳菌引起的BV通常通过抗生素治疗,如甲硝唑和克林霉素。然而,由于阴道加德纳菌的多样性和抗生素耐药性的增加,抗生素治疗可能面临治疗失败和复发的风险。近年来,研究者开始探讨通过调整阴道微生态环境来预防和治疗BV的方法,包括益生菌治疗和阴道pH调节剂的使用。
例如,Severgnini等[10](2022)的研究表明,通过益生菌治疗可以有效恢复阴道内的乳酸杆菌平衡,从而抑制阴道加德纳菌的过度生长,并减少BV的复发率。此外,该研究还表明,调节阴道pH值也可以作为一种有效的预防措施,因为低pH值的阴道环境有助于抑制阴道加德纳菌和其他致病菌的生长。
尽管抗生素仍然是治疗阴道加德纳菌感染的主要手段,但随着对该菌的遗传多样性和致病机制的深入研究,未来可能会开发出更具针对性和有效的治疗方法,如针对特定基因型的疫苗或基于微生物群的疗法。此外,通过推广健康的性行为和阴道卫生习惯,减少BV的发生率也是一项重要的公共卫生策略。
参考文献
[1] Piot P, Dyck E V, Totten P A, et al. Identification of Gardnerella (Haemophilus) vaginalis[J]. Journal of Clinical Microbiology, 1982, 15(1): 19-24.
[2] Greenwood J R, Pickett M J. Transfer of Haemophilus vaginalis Gardner and Dukes to a new genus Gardnerella: G. vaginalis (Gardner and Dukes) comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 1980, 30: 170-178.
[3] Piot P, Van E C K, Dyck, et al. Identification of Gardnerella (Haemophilus) vaginalis[J]. Journal of Clinical Microbiology, 1982, 15: 19 – 24.
[4] Tarracchini C, Lugli G A, Mancabelli L, et al. Assessing the Genomic Variability of Gardnerella vaginalis through Comparative Genomic Analyses: Evolutionary and Ecological Implications[J]. Applied and Environmental Microbiology, 2020, 87.
[5] Yeoman C J, Yildirim S, Thomas S M, et al. Comparative Genomics of Gardnerella vaginalis Strains Reveals Substantial Differences in Metabolic and Virulence Potential[J]. PLoS ONE, 2010, 5.
[6] Plummer E L, Vodstrcil L A, Murray G L, et al. Gardnerella vaginalis clade distribution is associated with behavioural practices and Nugent Score in women who have sex with women[J]. The Journal of infectious diseases, 2019.
[7] Catlin B W. Gardnerella vaginalis: characteristics, clinical considerations, and controversies[J]. Clinical Microbiology Reviews, 1992, 5: 213 – 237.
[8] Balashov S V, Mordechai E, Adelson M E, et al. Identification, quantification and subtyping of Gardnerella vaginalis in noncultured clinical vaginal samples by quantitative PCR[J]. Journal of medical microbiology, 2014, 63 Pt 2: 162-75.
[9] Schellenberg J J, Patterson M H, Hill J E. Gardnerella vaginalis diversity and ecology in relation to vaginal symptoms[J]. Research in microbiology, 2017, 168 9-10: 837-844.
[10] Severgnini M, Morselli S, Camboni T, et al. Gardnerella vaginalis clades in pregnancy: New insights into the interactions with the vaginal microbiome[J]. PLoS ONE, 2022, 17.
.png)
