1.卫氏并殖吸虫(Paragonimus westermani)
拉丁学名:Paragonimus westermani
分类学地位:动物界Animalia;扁形动物门Platyhelminthes;
吸虫纲Trematoda;复殖目Digenea;并殖科Paragonimidae;
并殖吸虫属Paragonimus
卫氏并殖吸虫(Paragonimus westermani),又称肺吸虫,感染途径通常是生食或半生食含活囊蚴的中间宿主及转续宿主,主要寄生在人及其他哺乳动物的肺部,导致肺部形成囊肿等病变。典型症状为患者咳出烂桃样血痰。该寄生虫是并殖吸虫病的主要病原体之一。
1.1生物学特性
1.1.1生活史
卫氏并殖吸虫终宿主是人。第一中间宿主为蜷科和黑贝科淡水螺中的某些螺类,第二中间宿主为甲壳纲的淡水蟹和蝲蛄。保虫宿主为多种肉食性哺乳动物,主要是猫科、犬科和灵猫科动物。
生活史过程包括卵、毛蚴、胞蚴、母雷蚴、子雷蚴、尾蚴、囊蚴(脱囊后称后尾蚴)、童虫及成虫等阶段。成虫主要寄生在宿主的肺。产出的虫卵通过与虫囊相通的支气管随痰液吐出,或痰被宿主吞食后随粪便排出。虫卵若进入水中,在适宜的温度(25-30℃)下,约3周后可孵出毛蚴,毛蚴钻入第一中间宿主体内,经胞蚴、母雷蚴及子雷蚴发育产生许多尾蚴。尾蚴成熟后自螺体逸出,主动侵入或随螺体被吞进第二中间宿主,发育成囊蚴。囊蚴呈球形或近球形,乳白色,直径为300-400 μm,具有两层囊壁,囊内含有一条卷曲的后尾蚴。终宿主因生食或半生食含有活囊蚴的淡水蟹或嫩蚴而感染,也可通过生食或半生食转续宿主的肉类或吃了被活囊蚴污染的食物或生水而感染。囊蚴到达终宿主的小肠后,在胆汁和消化液的作用下,后尾蚴自囊中脱出为童虫。童虫具有很强的穿透能力,穿过肠壁进人腹腔,游走于腹腔脏器之间或侵入邻近组织及腹壁,经1-3周的移行,穿过横膈经胸腔进入肺,在肺组织中发育为成虫。从感染囊蚴至成虫产卵需2-3个月。成虫在人体内一般可存活5-6年,个别情况下可达20年[1]。
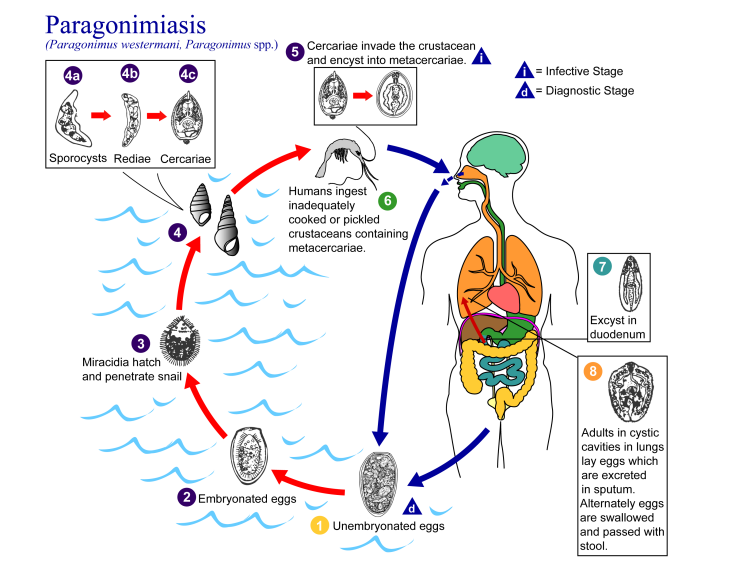
图1 卫氏并殖吸虫生活史[2]
1.1.2形态学特征
(1)成虫:体肥厚,椭圆形,背面隆起,腹面扁平。活虫呈暗红色,半透明,固定后呈灰白色。大小(7.5-12) mm×(4-6) mm×(3.5-5) mm。体表密布细小的体棘。口吸盘位于虫体前端,腹吸盘位于虫体中线之前,腹吸盘后缘为生殖孔,口、腹吸盘大小相近。消化道由口、咽、食道和两支肠管组成,两肠支在虫体两侧向后弯曲延伸,末端为盲端。卵巢分为5-6叶,与盘曲的子宫并列于腹吸盘之后。卵黄腺由许多卵黄滤泡组成,分布在虫体两侧。睾丸2个,细小,如指状分支,左右并列于虫体后1/3处。因雌雄生殖器官左右并列,故称为并殖吸虫(图2A)。
(2)虫卵:椭圆形,金黄色,大小为(80-118) μm×(48-60) μm较宽的一端有一大而明显的卵盖,常略倾斜,亦有缺卵盖者。卵壳厚薄不均匀,卵盖对端卵壳常增厚。卵内含有一个卵细胞和10-20个卵黄细胞(图2B)[1]。
(3)囊蚴:呈圆球形或椭圆形,具有两层囊壁,外壁薄,内壁厚,囊内后尾蚴肠管呈螺旋状弯曲,排泄囊占两肠支之间全部空隙,内含无数黑色折光颗粒[3]。
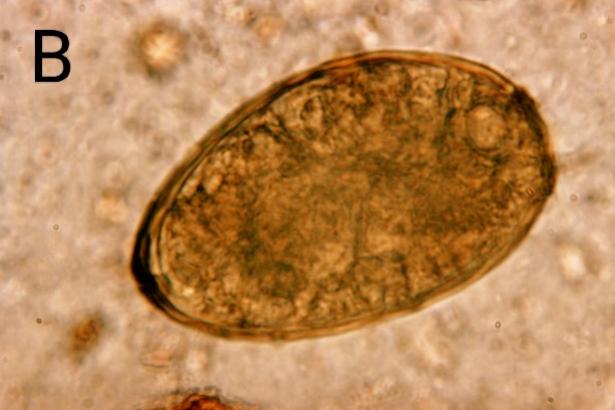
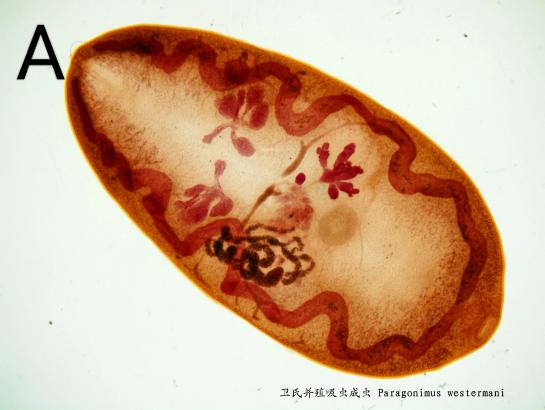
图2 卫氏并殖吸虫形态结构
A:成虫[4],B:虫卵[5]
1.1.3生化特征
卫氏并殖吸虫的虫卵只有入水才能发育成毛蚴。未成功钻入螺蛳的毛蚴在水中仅可存活1-3天。在室内条件下,尾蚴在水中通常可存活1-2天。囊蚴在水中于适宜温度条件下大多在几天内脱囊,而脱囊的后尾蚴在水中1天内便会死亡[6]。
1.2分布、传播与致病性
1.2.1分布与传播
卫氏并殖吸虫呈世界性分布,但人体感染主要东南亚国家,俄罗斯、非洲和南美洲也有报道。在中国,除西藏、新疆等少数地区外,其他省份均有感染病例,其中浙江、台湾、福建等地流行较为严重。
并殖吸虫病是一种人兽共患寄生虫病,具有自然疫源性,传染源为能排出虫卵的人和肉食性哺乳动物[1]。同时,并殖吸虫病是一种食源性寄生虫病,流行区居民因生食或半生食含有囊蚴的溪蟹、蝲蛄而感染,这是主要的传播途径。此外,生食转续宿主(如野猪)的肉及其制品,或饮用含囊蚴的疫水,也可能导致感染[7]。
1.2.2致病性
卫氏并殖吸虫的童虫或成虫在组织器官内移行及寄居造成宿主的机械性损伤,以及代谢产物引起免疫病理反应。病变发展过程可分为急性期和慢性期。
急性期主要为童虫移行所致。童虫穿过肠壁引起局部出血或脓性窦道:在腹腔移行可引起炎性渗出,内含大量嗜酸性粒细胞;在肝表面移行或穿过肝组织,引起局部出血、坏死;虫体穿过横膈、脾处可形成点状出血、炎症等。
慢性期为童虫在肺部发育及成虫寄生引起的病变,其病理变化过程大致可分为三期。①脓肿期:主要因虫体在组织器官内移行,造成隧道状、窟穴状组织损伤和出血,继而出现以中性粒细胞和嗜酸性粒细胞为主的炎性渗出,逐渐形成脓肿。病灶周围形成肉芽组织,构成薄膜状脓肿壁。X线片显示边缘模糊、界限不清的浸润性阴影。②囊肿期:因脓肿内大量浸润的细胞变性、坏死、液化,液体逐渐吸收,脓肿内容物逐渐呈赤褐色黏稠状,内含大量虫卵和夏科-莱登(Charcot-Leyden)结晶。囊壁因肉芽组织增生而变厚,形成边界清楚的结节状虫囊。X线片显示边缘锐利的结节状阴影。若虫囊相互贯通,则可显示多房性囊样阴影。③纤维瘢痕期:虫体死亡或转移,其内容物逐渐被吸收或排空,囊腔被肉芽组织填充,继而纤维化形成瘢痕。X线片显示硬结性或条索状阴影。由于虫体在肺组织内不断移行,新的病灶不断出现,因此以上三病变常可同时并存[1]。
1.3检测方法
(1)病原学检查:从痰液或粪便中检出虫卵是确诊的依据。痰液可采用直接涂片法检查。轻症患者收集24小时痰液,加等量10%氢氧化钠溶液,消化至痰液完全溶解,离心,取沉淀镜检。粪检方法为直接涂片或浓集法。手术摘除皮下包块、结节检获虫体或虫卵可确诊,也可根据局部典型的病理变化进行诊断[1]。
(2)免疫学检测:酶联免疫吸附试验(ELISA)灵敏度高,特异度强,阳性率可达90%-100%,是普遍使用的方法,用于本病的辅助诊断和流行病学调查[8]。用碳酸盐缓冲液稀释抗原并包被在微量聚苯乙烯塑料板的反应孔中,置于4℃冰箱过夜。次日洗涤后,加入稀释的受检者血清或参考血清,37℃孵育1小时。洗涤后,加入稀释的酶标记结合物,再次孵育1小时。洗涤后,加入底物溶液(如OPD),37℃孵育30分钟,最后加硫酸终止反应。结果判定通过在酶标比色计上读取光密度(OD)值,若血清检测值/阴性参考值(P/N)≥2.1,则判定为阳性[9]。
1.4典型案例
在2017年至2019年期间,云南省昭通市进行了一项并殖吸虫血清流行病学调查,结果显示,该地区5至15岁儿童的并殖吸虫IgG抗体阳性率为3.14%,显著高于成人的0.52%。调查发现,饮用生溪水是并殖吸虫感染的重要危险因素,多因素分析显示,经常饮用生溪水的人群感染风险显著增加,其OR值为3.58(95% CI:1.10-11.80)。昭通市溪流众多,溪水中可能存在并殖吸虫的中间宿主(如溪蟹)或其囊蚴,儿童在溪边玩耍时直接饮用生水,增加了感染风险[10]。
1.5防治对策
预防卫氏并殖吸虫致病的关键措施是加强教育,避免生食或半生食溪蟹、蝲蛄、转续宿主的肉类及其制品,同时不饮生水和不随地吐痰。加强粪便和水源管理,防止虫卵污染水源。治疗患者和带虫者,控制或治疗保虫宿主,以减少传染源。治疗首选药物是吡喹酮,具有疗效高、毒性低、疗程短等优点。阿苯达唑亦有较好的疗效,尤其对皮下结节患者效果显著[1]。
参考文献
[1] 刘尔翔, 王恒. 中华医学百科全书 基础医学 医学寄生虫学. 北京: 中国协和医科大学出版社, 2023.
[2] https://phil.cdc.gov/Details.aspx?pid=3415.
[3] 沈晓玲,木兰,王利. 病原生物学与免疫学实验指导. 南京: 江苏凤凰科学技术出版社, 2022.
[4] https://www.tdrc.org.cn/html/1/282/14.html.
[5] https://phil.cdc.gov/Details.aspx?pid=4844.
[6] 蔡茂荣, 李友松, 程由注. 福建省肺吸虫与肺吸虫病. 厦门: 厦门大学出版社, 2021.
[7] 柳建发, 王中全. 医学寄生虫学. 北京: 中国医药科技出版社, 2011.
[8] 陈轶玉, 于爱莲. 病原生物学与免疫学 第3版. 南京: 江苏凤凰科学技术出版社, 2018.
[9] 中华人民共和国卫生部. WS 380—2012 并殖吸虫病的诊断. 北京: 中国标准出版社, 2012.
[10] 龙应欢, 王阳峰, 顾芳 等. 昭通市人群并殖吸虫血清流行病学调查结果分析. 应用预防医学, 2020, 3: 512-514.
.png)
