1.立克次体(Rickettsia)
物种名:立克次体
拉丁学名:Rickettsia
分类学地位:细菌界Bacteria;变形菌门Proteobacteria;
α-变形菌纲Alphaproteobacteria;立克次体目Rickettsiales;
立克次体科Rickettsiaceae;立克次体属Rickettsia
立克次体(Rickettsia)为革兰氏阴性菌,是一类专性寄生于真核细胞内的原核生物,介于细菌与病毒之间,而接近于细菌,没有核仁及核膜。一般呈球状或杆状,主要寄生于节肢动物,有的会通过蚤、虱、蜱、螨叮咬或其粪便污染伤口传入人体,引起斑疹伤寒、战壕热等疾病。立克次体在1906年由青年医生Howard Taylor ricketts首先发现并报道。主要致病的立克次体有莫氏立克次体、普氏立克次体和恙虫病东方体等[1]。
1.1生物学特性
1.1.1培养特征
立克次体为专性细胞内寄生,以二分裂方式繁殖,繁殖一代需9-12小时。立克次体具有相对较完整的能量产生系统,能氧化三羧酸循环中的部分代谢产物,有较独立的呼吸与合成能力,但仍需从宿主细胞中获得辅酶A、NAD及代谢中所需的能量才能生长繁殖。常用的培养方法有细胞培养、鸡胚卵黄囊接种和动物接种。多种病原性立克次体在小鼠和豚鼠体内繁殖良好。目前采用鸡胚成纤维细胞、1929细胞和Vero单层细胞进行分离、鉴定、传代和培养,最适温度为37℃[2]。
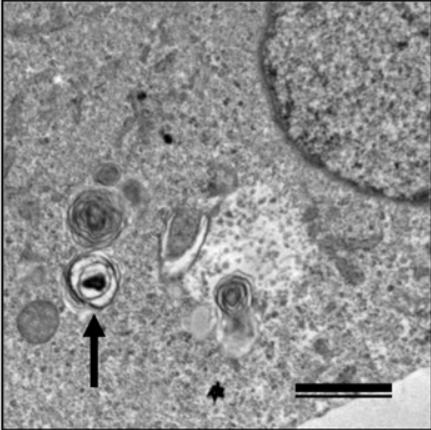
图1 感染立克次体的Vero细胞的电镜照片[3]
1.1.2形态学特征
立克次体呈多形性,球杆状或杆状多见,在不同发育阶段不同宿主内可出现不同形态,如长杆状、丝状或哑铃状,大小为0.3-0.6 μm×0.8-2.0 μm。在感染细胞内,立克次体常聚集成致密团块状,但也可成单或成双排列。不同立克次体在细胞内位置有差异,此特点可供初步识别。如普氏立克次体在胞质内分散存在;恙虫病东方体多在胞质近核处成堆排列;立氏立克次体可在胞质内和核内生长。革兰染色阴性,但着色不明显,因此常用Giemsa法染色,立克次体被染成蓝色或紫色,常有两极浓染;也可用Gimenez法或Macchiavello法,前者立克次体被染成红色,后者染成紫红色[4]。
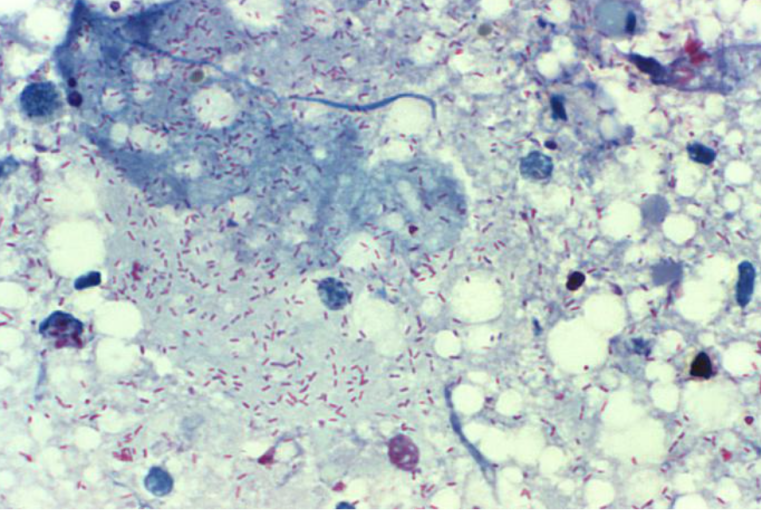
图2 立克次体的Gimenez染色卵黄囊涂片的显微照片[5]
1.1.3生化特征
立克次体抵抗力均较弱,可被56℃、0.5%苯酚和75%酒精数分钟灭活。在节肢动物粪便中可存活1年以上。离开宿主迅速死亡,但在-20℃或冷冻条件下可保存数年。对四环素、利福平、强力霉素等抗生素敏感,但磺胺类药物则可促进其生长繁殖[6]。
1.2分布、传播与致病性
1.2.1分布与传播
立克次体病是一类人兽共患的自然疫源性疾病。人体通过感染立克次体的昆虫叮咬或接触其粪便而感染,多发生于热带与亚热带国家和地区。
斑疹伤寒群立克次体如普氏立克次体,通过人类体虱进行传播,体虱叮咬人类皮肤形成伤口,并通过粪便感染这些伤口,从而引起流行性斑疹伤寒。斑点热群立克次体如立氏立克次体,其主要通过蜱类传播,受环境湿度和温度、自然植被与野生动物、人类活动及杀虫剂应用等因素的影响,呈现地域流行性特征。恙虫病由恙虫病东方体引起,通过恙螨幼虫传播,主要分布于丛林地区,也称丛林斑疹伤寒[7]。
1.2.2致病性
立克次体可导致人的流行性斑疹伤寒(普氏立克次体)、洛矶山斑点热(立氏立克次体)、鼠/地方性斑疹伤寒(斑疹伤寒立克次体)、恙虫病(恙虫东方体)等。
立克次体侵入人体后,先在局部淋巴组织或小血管内皮细胞中繁殖,引起初次菌血症。再经血液扩散至全身器官的小血管内皮细胞中繁殖后,大量立克次体释放人血导致第二次菌血症。由立克次体崩解释放的内毒素等毒性物质也随血液流向全身,引起毒血症。立克次体损伤血管内皮细胞,引起细胞肿胀和组织坏死,血管通透性增强,导致血浆渗出、血容量降低以及凝血机制障碍、DIC(弥散性血管内凝血)等。常伴有全身实质性脏器的血管周围广泛性病变,皮肤可出现皮疹,肝、脾、肾等则出现相应脏器损害症状。晚期机体内由于抗原抗体复合物的形成,可加重临床症状,甚至可因心、肾衰竭而死亡[6]。
1.3检测方法
(1)传统方法:分离细胞培养检测、药物敏感试验以及采集患者血液或病体的生物标本进行检测[8]。
(2)免疫学方法:免疫学直接检测,通过皮肤活检标本的冷冻切片或甲醛固定、石蜡包埋、切片,使用荧光标记的抗立克次体单克隆或多克隆抗体,DFA法染色切片;或使用血清学检测,IFA为血清学金标准,其他血清学方法有胶乳凝集法、EIA免疫印迹法[8]。
(3)分子生物学法:PCR法、荧光PCR法、巢式PCR法等。如使用多重荧光PCR检测,通过对引物浓度、退火温度及循环参数进行反复优化后选择PCR反应体积及DNA模板,反应条件为95℃ 10 min后,95℃ 15 s,58℃ 1 min,45个循环。分别将恙虫东方体、莫氏立克次体、斑点热立克次体阳性对照DNA原液稀释成101、102 copies/μL,应用多重荧光PCR检测体系和条件进行扩增,检测到的最低浓度,再进行同一时间内和不同时间内分别重复扩增3次。结果判定:扩增曲线呈S型且Ct值≤38阳性,Ct值≥41阴性,38<Ct值<40应重复检测[9]。
表1 多重荧光PCR检测引物及探针[9]
| 病原体 | 荧光基团-序列-淬灭基团(5’→3’) | 扩增大小 |
| 恙虫东方体 | CAGAAGGTATCTACAGTGCAGCC GCTTCTCCGTCTACATCATCAG
FAM-TGTGCTTGAAGCTGTTGCTCACACTG-BHQ1 |
101bp |
| 莫氏立克次体 | TGTTCTGCGATGTTATAGAAAGGT GAAACTGCTGATGTTGGTGGAT
ROX-TGATCAATCGCTTCATCACCTGAAGA-BHQ2 |
113bp |
| 斑点热群立克次体 | ATATTGCTCAAAATACCGTTGTTG
AAGTTAAGCTTTTGCCGACAGT VIC-ACGGGAGGTAACTTGTTGCCTGTTAC-BHQ1 |
87bp |
1.4典型案例
里约热爆发了巴西斑疹热,最初发现在犬的身上,而后感染了该地区的人类并引起了死亡。在通过观察感染的犬血清确定动物感染的可能病原体,发现是由立克次体所引起的斑疹热。该地区拥有独特的水文环境,卡兰戈拉河流经城市的整个长度,甚至与城市的商业中心接壤,同时该地区的温度也很适合立克次体的存在,因此动物与易感染环境的持续接触,导致了斑疹热的爆发[10]。
1.5防治对策
防治立克次体病应注意消灭传播媒介,灭虱、灭蚤、灭蜱、灭螨等,搞好环境卫生,外出旅游,尤其是深人丛林、草原等自然疫源地,需注意个人防护,避免和宠物密切接触。特异性预防主要是接种疫苗。治疗可用氯霉素、四环素和多西环素类抗生素,严禁使用磺胺类药物[6]。
参考文献
- https://baike.baidu.com/item/立克次氏体/462950.
- 汪晓静, 谷存国. 病原生物与免疫. 北京: 中国科技医药出版社, 2022.
- Uchiyama T. Tropism and pathogenicity of rickettsiae. Frontiers in microbiology, 2012, 3: 230.
- 王桂琴, 陈云霞. 医学微生物学. 北京: 中国医药科技出版社, 2023.
- https://phil.cdc.gov/Details.aspx?pid=10953.
- 杨文, 沈萍, 欧阳艳. 动物微生物与免疫技术. 武汉: 华中科技大学出版社, 2022.
- 张骁鹏, 李炘檑, 郑波 等. 立克次体与立克次体病的检测与鉴定. 微生物与感染, 2015, 10: 194-198.
- 朱书照. 现代医学检验与新技术. 上海: 上海科学普及出版社, 2023.
- 亚红祥, 董珊珊, 杨智明 等. 立克次体多重荧光PCR检测方法的建立及初步应用. 海峡预防医学杂志, 2024, 30: 61-64.
- Poubel IT, Cunha NC, Fonseca ABM et al. Seroprevalence of Rickettsia rickettsii and Rickettsia parkeri in dogs during a Brazilian Spotted Fever outbreak in the State of Rio de Janeiro. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 2018, 70: 667-674.
.png)
