1.猴免疫缺陷病毒(Simian immunodeficiency virus)
物种名:猴免疫缺陷病毒
拉丁学名:Simian immunodeficiency virus
分类学地位:副核糖病毒界Pararnavirae;酶录转逆病毒门Artverviricota;
逆转录病毒纲Revtraviricetes;逆转录病毒目Ortervirales;
逆转录病毒科Retroviridae;慢病毒属Lentivirus
猴免疫缺陷病毒(Simian immunodeficiency virus, SIV),也称为非洲绿猴病毒,是一种可影响至少33种非洲灵长目的逆转录病毒,与人类免疫缺陷病毒(HIV)同属慢病毒属。猴免疫缺陷病毒在自然宿主中通常不引发严重疾病,但感染亚洲或非洲的非自然宿主(如:恒河猴)可导致类似艾滋病(AIDS)的免疫缺陷综合征。最初于1985年从患有猴艾滋病的普通猕猴体内分离出来。目前,SIV是用于研究HIV/AIDS的重要动物模型,尤其是疫苗和抗病毒药物的研究[1]。
1.1生物学特性
1.1.1培养特征
猴免疫缺陷病毒可在培养的猴巨噬细胞内生长,也可在人T淋巴细胞株内及原代培养的人或猴外周血单核细胞内增殖。在巨噬细胞上可出现胞体膨大、空泡化,但较少裂解;在T细胞的感染后期出现细胞圆缩、膜起泡、凋亡小体等现象。
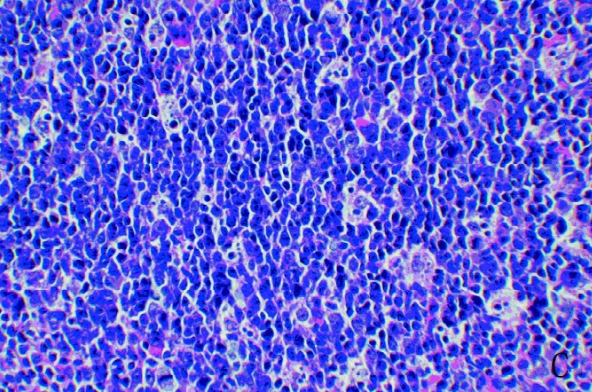
图1 感染SIV的猕猴巨噬细胞增生现象[2]
1.1.2形态学特征
猴免疫缺陷病毒颗粒为球形,直径为80-100 nm,主要由核壳体、衣壳、基质和包膜组成。核衣壳由病毒基因组和蛋白质缠绕而成,主要成分为蛋白质,位于病毒粒子的中央,呈平截的锥状。包膜由脂质和糖蛋白组成,表面有均匀分布的刺突,有助于病毒吸附和侵人易感细胞[3]。
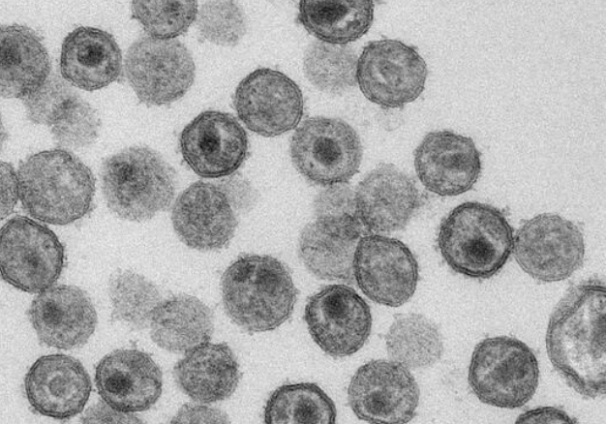
图2 SIV病毒颗粒的电镜图[4]
1.1.3生化特征
猴免疫缺陷病毒对外界的抵抗力不强,病毒颗粒对加热、去垢剂、脂溶剂和甲醛敏感。56℃ 30 min可将其灭活,蒸汽高压灭菌20 min可杀灭病毒颗粒,在10%漂白粉液、0.5%次氯酸钠、50%乙醇、35%异丙醇、0.3%双氧水、0.5%来苏尔等消毒液中,室温10 min便可被完全灭活。但紫外线照射不会影响猴免疫缺陷病毒颗粒的传染性[3]。
1.2分布、传播与致病性
1.2.1分布与传播
猴免疫缺陷病毒的自然宿主被认为是非洲绿猴,在青尼亚、埃塞俄比亚、南非及塞内加尔等地区的非洲绿猴中,20%-30%表现为SIV抗体阳性。猴对SAIDS的易感性存在种系差别,但易感性无性别差异;在白眉猴及狒狒中发现有SIV的自然感染。恒河猴可通过静脉、肌内注射或生殖道黏膜感染。SIV可能通过血液、唾液等进行水平传播,也可通过母婴途径发生垂直传播,性接触并非主要的传播途径[5]。
1.2.2致病性
猴免疫缺陷病毒对其天然宿主的感染在很多情况下不具有致病性,但其被认为已跨越了种间屏障而进入人体,并最终成为了HIV的两个亚型,即HIV-2和HIV-1。猴免疫缺陷病毒具有与HIV相同的生活周期,可选择性攻击猴CD4+细胞,并且猴免疫缺陷病毒与HIV病毒在基因序列上有较高的同源性,非人灵长类感染SIV后,出现类似AIDS的发病机制和临床症状表现。
SIV感染主要破坏免疫系统,其发病机制与人获得性免疫缺陷相似,CD4分子是病毒囊膜表面蛋白的受体,SIV主要攻击CD4+、T淋巴细胞亚群。SIV侵入细胞后,通过逆转录酶将病毒的RNA转录成DNA,整合入宿主DNA中,形成前病毒,并利用宿主细胞分裂增殖,产生病毒,致使宿主细胞死亡,释放出大量新病毒,攻击新的靶细胞,从而使T4淋巴细胞数量持续减少。此外,由于SIV对免疫系统的摧毁及病毒分子复制特性使得其能有效逃避机体免疫系统的识别和攻击[6]。
1.3检测方法
(1)传统方法:主要是病毒的分离培养,观察其形态及培养特征,判断其可能存在性。
(2)免疫学方法:主要有酶联免疫吸附试验(ELISA)、免疫荧光试验(IFA)、蛋白印迹(Western Blot)及免疫梳检测法(IC)等,其中IC法是能够对病毒血清抗体进行定性、定量检测的一项新型体外诊断技术,该方法具有快速、简便、经济、达到快速诊断的目的[7]。
(3)分子生物学方法:主要有巢式PCR法、RT-PCR法、荧光定量PCR法等。以巢式PCR法为例,先制备DNA样品,在SIV基因序列的高度保守区gag基因区,设计两对特异的PCR引物,具体序列如表1,配备反应溶液体系,PGAG1+PGAG2的反应条件:95℃ 5 min(×1),95℃ 45 s,58℃ 1 min,72℃ 1 min 30 s(×30),72℃ 5 min(×1);PGAG3+PGAG4的反应条件:95℃ 45 s,55℃ 1 min,72℃ 1 min(×30),72℃ 5 min(×1)[8]。
表1 巢式PCR内外引物序列[8]
| 引物名称 | 引物序列 |
| PGAG1 | 5’-CGGAATTCATGGAAACTATGCCAAAAAACAAG-3’ |
| PGAG2 | 5’-TTGTCGACTTATCATAATCAAGCCTTCTGTCCTG-3’ |
| PGAG3 | 5’-AATGAGGAGGCTGCAGATTGGGACTTG-3’ |
| PGAG4 | 5’-GCACATGCTTGCAATCTGGGTTAGC-3’ |
1.4典型案例
长期以来,马拉加拉西河一直被认为是坦桑尼亚西部黑猩猩迁徙的障碍。这种潜在的地理边界可能会影响黑猩猩的分布行为、种群连通性和病原体传播,从而对保护策略和政府政策产生影响。从该河附近收集了13个含有黑猩猩DNA的新鲜粪便样本,其中两个样本的检测出了猴免疫缺陷病毒的存在,最终证实了马拉加拉西河存在黑猩猩猴免疫病毒的基因流动和疾病传播[9]。
1.5防治对策
由于猴免疫缺陷病毒主要影响非人类灵长类动物(如猕猴、恒河猴),并不会直接感染人类。若从事灵长类动物研究、兽医或野生动物保护工作,则需加强防护意识,要穿戴防护手套、口罩和护目镜,避免被咬伤或抓伤。若皮肤有伤口,要避免接触猴类的血液、唾液或其他体液;此外,要保持良好的营养、运动和作息,增强免疫系统功能。
参考文献
- https://baike.baidu.com/item/猴免疫缺陷病毒/7822530.
- 张萍, 吴玉娥, 张钰 等. 猴免疫缺陷病毒感染猕猴淋巴结和脾脏的病理学观察. 实验动物与比较医学, 2012, 32: 265-269+278.
- 张延英, 席晓霞. 常用实验动物传染病. 兰州: 甘肃科学技术出版社, 2020.
- https://www.alamy.com/stock-photo/Simian-immunodeficiency-virus.html?sortBy=relevant
- 秦川, 刘德培. 医学实验动物学. 北京: 中国协和医科大学出版社, 2018.
- 王静, 张鈺, 闵凡贵 等. 猴免疫缺陷病毒(SIV)实时荧光定量PCR检测方法的建立. 中国比较医学杂志, 2013, 23: 68-72+60.
- 李丹丹, 王绥家, 陈平亚 等. 猴免疫缺陷病毒抗体免疫梳检测方法的建立及应用. 中国实验动物学报, 2018, 26: 217-223.
- 何伏秋, 潘勇, 丛喆 等. 巢式PCR检测猴免疫缺陷病毒基因. 中国人兽共患病杂志, 1996, 2: 3-6.
- Piel AK, Stewart FA, Pintea L, et al. The Malagarasi River Does Not Form an Absolute Barrier to Chimpanzee Movement in Western Tanzania. PLoS ONE, 2013, 8: e58965.
.png)
