1.溶藻弧菌(Vibrio alginolyticus)
物种名:溶藻弧菌
拉丁学名:Vibrio alginolyticus
分类学地位: 细菌界 Bacteria;变形菌门Proteobacteria;
γ-变形菌纲Gammaproteobacteria;弧菌目Vibrionales;
弧菌科Vibrionaceae;弧菌属Vibrio
溶藻弧菌(Vibrio alginolyticus)作为四大致病弧菌之一,可引起鱼虾的系统性疾病以及人类肠道和创伤性伤口感染,其毒力因子的表达及致病性与细胞密度紧密相关[1],溶藻弧菌属于弧菌属,是一种革兰氏阴性短杆菌。它最初在1961年被发现,当时被命名为Oceanomona alginolytica,但在1968年被更名为Vibrio alginolyticus。这种细菌具有多种特点:1.它是兼性厌氧菌,这意味着它可以在有氧或无氧的环境中生存。2.它是一种嗜盐嗜温的微生物,生长的最佳环境通常在pH为6.0~9.0、含1~10% NaCl的培养基中,是一种中度嗜盐菌。3.溶藻弧菌在海水或淡水中都能生存,特别是在夏季或秋季的海水养殖环境中更为常见。
1.1生物学特性
1.1.1培养特征
将溶藻弧菌接种在培养基LBS中,在30 ℃的条件下培养.大肠杆菌接种于LB培养基中,在37 ℃的条件下培养。液体培养基于摇床200 rpm 培养,固体培养基静置培养。通过脱脂牛奶平板定性测定溶藻弧菌WT、突变株Δ0087和回补株0087+的胞外蛋白酶变化,结果如图1所示。突变株Δ0087菌落直径相对于野生株而言变小且在其菌落四周并未形成肉眼可见的透明圈;回补株0087+能够形成与野生株几乎相同的透明圈,但其菌落直径小于野生株。由此可见,sRNA0087对溶藻弧菌胞外蛋白酶的合成具有正向调控作用。溶藻弧菌胞外蛋白酶、运动性以及生物被膜等均受到群体感应系统的影响[1]。
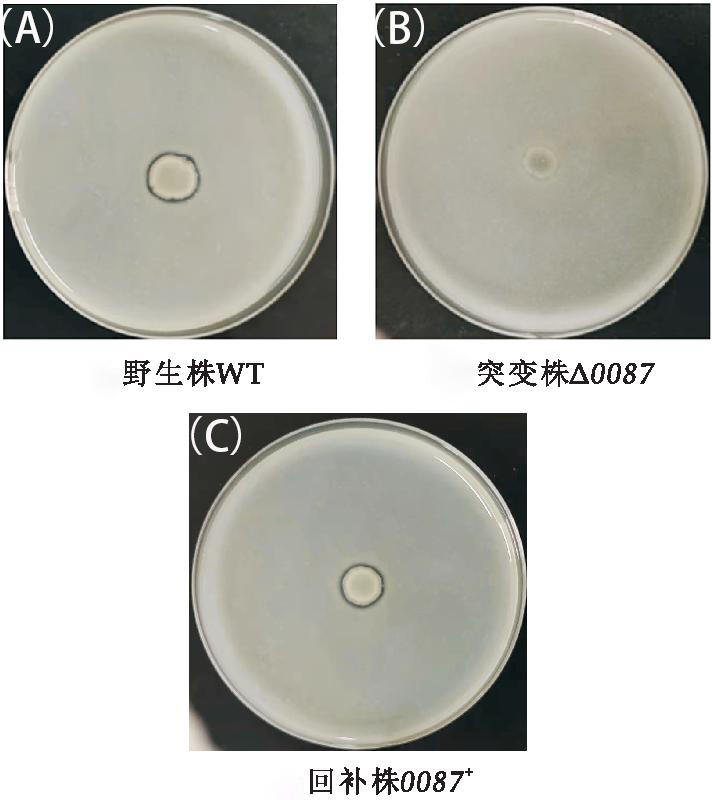
图1 溶藻弧菌胞外蛋白酶测定(A)野生株WT(B)突变株▲0087(C)回补株0087
1.1.2形态学特征
患病斜带石斑鱼病变组织的TCBS平板培养结果如图2所示,病原菌的菌落呈黄色、圆形、略微隆起、具有光泽和黏性且边缘光滑。经革兰氏染色为阴性菌,经过测序发现是溶藻弧菌[1]。
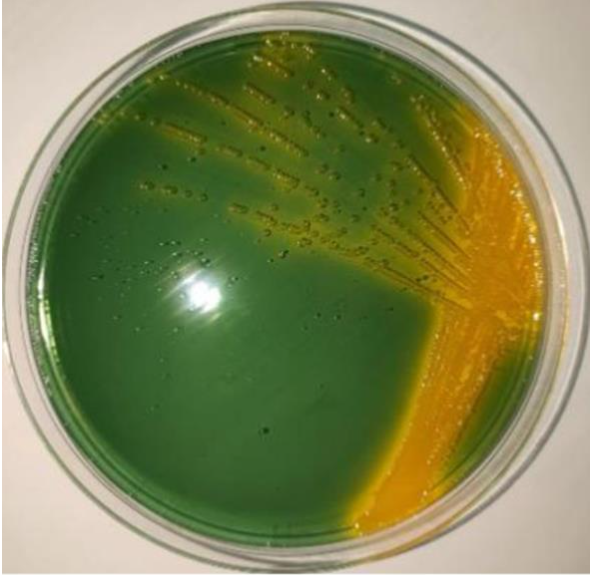
图2 溶藻弧菌菌落形态
1.1.3生化特征
对溶藻弧菌EPGS在低密度(2 h)和高密度(9 h)下总RNA进行质量分析,结果如图3所示。由图3可以看到,23S rRNA和16S rRNA两条明亮清晰的条带,且没有受到gDNA的污染,OD260/OD280分别为1.95和1.97,所提取的总RNA质量符合后续转录组测序要求。
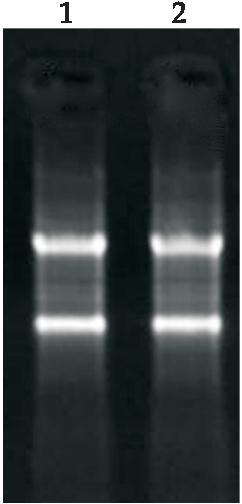
图3 溶藻弧菌RNA完整性和gDNA污染电泳分析(Lane 1:2 h; Lane 2:9 h)
使用Mfold预测sRNA0087的二级结构,结果如图4所示。sRNA0087具有典型的RNA二级结构,包含4个茎环、3个内环、2个凸环以及未能碱基配对的单链结构区组成[1]。
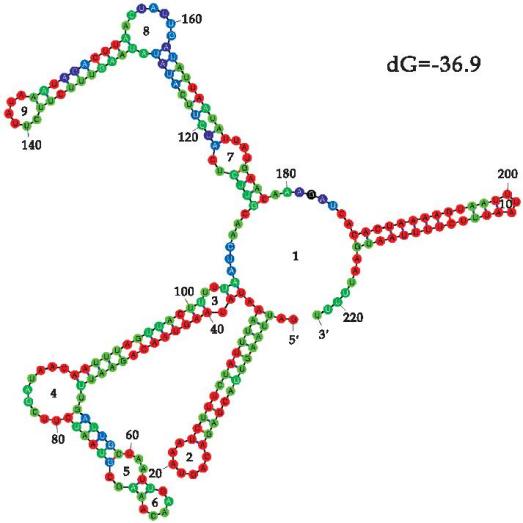
图4 溶藻弧菌sRNA0087二级结构预测图
1.1.4 分子生物学特征
毒力因子:
1、胞外产物 (ECP)
溶藻弧菌可产生多种胞外产物, 具备多种活性, 是对宿主致病的主要毒力因子之一,溶藻弧菌的ECP可引起日本对虾血浆中抗脂多糖因子消失、血蓝蛋白减少, 对虾致病起到重要作用。病原弧菌ECP中与致病有关的毒力因子包括蛋白酶类及外毒素。
蛋白酶类:Long等[2]首先报道了溶藻弧菌能产生碱性丝氨酸蛋白酶,Hare等[3]研究了外界因子对溶藻弧菌所产生的胶原蛋白酶和碱性丝氨酸蛋白酶的影响。结果表明, 温度、氧气对这两种胞外酶产生的影响是特定的, 与菌的环境适应性有关, 如稳定生长期的菌在缺氧条件下, 温度的突变会抑制酶的产生, 而在正常状态下则不会受到温度的影响。
外毒素类:Baffone等[4]对20株海域分离的溶藻弧菌进行了研究, 结果表明, 5% (1株) 的菌可产生肠毒素并导致小白鼠致病, 但均无溶血活性
2、脂多糖
在弧菌病原中, 鳗弧菌、创伤弧菌、霍乱弧菌、拟态弧菌、病海鱼弧菌、副溶血弧菌等的LPS都被证明与弧菌的致病过程有关, 是重要的致病因子。
3、载铁体
铁是细胞色素及过氧化氢酶的组成成分, 为细菌生长、繁殖所必需。宿主体内的铁主要存在于红细胞及转铁蛋白、乳铁蛋白中, 游离铁极少, 无法满足细菌生长、繁殖的需要。为了在宿主体内生存、繁殖, 病原弧菌主要有两种获铁途径:一是产生外毒素破坏红细胞, 释放血红素;二是产生一种对铁具有高度亲和性, 可从转铁蛋白、乳铁蛋白中摄取铁的鳌合剂即载铁体[5]。
1.2分布、传播与致病性
1.2.1 分布与传播
溶藻弧菌是一种条件致病菌,主要影响海水养殖的鱼类、虾类、贝类等动物,引起如虾苗的幼体菌血病、对虾的红体病和白斑病等疾病。其致病机理包括粘附、侵袭、体内增殖及产生毒素等一系列过程。
1.2.2 致病性
溶藻弧菌对鱼、虾、贝等都有较强的致病性,其对不同种类表现不同程度的毒性。另外,其不同菌株也表现出强弱不同的毒性, 如‘CAN’菌株对黑鲷 (Sparus aurata) 的毒性 (LD50 5.4×104 CFU/g) 是‘16’菌株的18倍左右 (LD50 1.0×106 CFU/g)[6]。黄志坚等[7]研究表明,以肌肉注射方式感染的鲑点石斑鱼死亡率较高, 达100%,症状最为明显, 多在一周内死亡,致病力最强;其次是腹腔注射和划痕浸泡感染方式死亡率为80%;未划痕浸泡感染和口服感染组也有一定的致病力,死亡率分别为40%和60%
1.3检测方法
国内对于溶藻弧菌的检测, 在大黄鱼方面研究的比较多。王军等 (2002) 建立了大黄鱼病原菌溶藻弧菌的间接荧光抗体检测方法, 现场检测结果显示该方法对具有典型症状的发病大黄鱼的病原检出率为100%,表观健康大黄鱼病原检出率为30%。鄢庆枇等 (2001)[8] 进行溶藻弧菌的ELISA快速检测方法研究,以甲醛灭活方法获得菌苗,通过免疫动物获得抗血清, 该抗血清经吸附后与副溶血弧菌、河流弧菌等10株对照菌株无交叉反应,对溶藻弧菌的最低检测极限可以达到97 000 CFU/ml。另外宋晓玲等 (2001) [9] 建立了检测溶藻弧菌的单抗-ELISA技术,该反应系统可用于溶藻弧菌的快速诊断,反应时间为6~7 h,检测灵敏度为104CFU/ml。Sparagano等(2002)[10]根据23S rRNA序列设计引物进行PCR检测,能够从种的水平上鉴定和区分亲缘关系很近的哈维氏弧菌、溶藻弧菌等弧菌属细菌。
1.4典型案例
对马来半岛的养殖虾进行了采集检测,检出了溶藻弧菌;对兰州市螺类水产品进行致病性弧菌检测,溶藻弧菌占比达30.29%[11]。
1.5防治对策
一、源头控制
- 水质监测:定期对水源进行监测,包括检测水体中的溶藻弧菌含量及其他水质指标,如pH值、溶解氧、氨氮等,确保水质安全。
- 污染源控制:查明并控制溶藻弧菌的污染源,如工业废水、农业面源污染、生活污水等,减少其进入水体的机会。
二、水体处理
- 物理处理:
(1)过滤:采用适当的过滤设备去除水体中的悬浮物、有机物等,减少溶藻弧菌的附着和滋生环境。
(2)曝气:增加水体中的溶解氧含量,抑制厌氧菌(包括部分溶藻弧菌)的生长。
- 化学处理:
(1)消毒剂:使用含氯消毒剂、二氧化氯等化学消毒剂杀灭水体中的溶藻弧菌。但需注意消毒剂的使用量,避免对水生生物造成危害。
(2)氧化剂:如过硫酸氢钾等,可以氧化水体中的有机物,降低溶藻弧菌的滋生环境。
- 生物处理:
(1)有益微生物:投加特定的有益微生物,如芽孢杆菌、噬菌蛭弧菌等,形成有益菌群,抑制溶藻弧菌的生长和繁殖。
(2)生态修复:通过种植水生植物、构建人工湿地等方式,恢复水体的自然净化能力,降低溶藻弧菌的污染风险。
三、环境管理
- 加强监管:加大对水体污染的监管力度,对违法排污行为进行严厉打击。
- 宣传教育:提高公众对水体污染的认识和环保意识,鼓励大家共同参与水污染防治工作。
- 科学规划:合理规划工业布局、农业生产和城市建设等,避免对水体造成污染。
参考文献
- 李莹,李印可,周欣等. 溶藻弧菌细胞密度相关sRNA的鉴定及其对毒力的调控作用 [J]. 陕西科技大学学报, 2023, 41 (01): 52-58. DOI:10.19481/j.cnki.issn2096-398x.2023.01.015.
- Long S, Mothibeli MA, Robb F T, et al.Regulationof extracellular alkaline protease activity by histidinein a collagenolyticVibrio alginolyticusstrain[J].Journal of General Microiology, 1981, 127:193-199.
- Hare P, Long S, Robb F T, et al.Regulation of exo-protease production by temperature and oxygen inVibrio alginolyticus[J].Arch Microbiol, 1981, 130:276-280.
- Baffone W, Citterio B, Vittoria E, et al.Determina-tion of several potential virulence factors inVibriospp.isolated from seawater[J].Food Microbiology, 2001, 18, 479-488.
- 吴后波, 潘金培.病原弧菌的致病机理[J].水生生物学报, 2003, 27 (4) :422-426.
- Balebona MC, Andreu MJ, Bordas MA, et al.Path-ogenicity ofVibrio alginolyticusfor Cultured Gilt-Head Sea Bream (Sparus aurataL.) [J].Applied andEnvironmental Microbiology, 1998, 64:4 269-4 275.
- 黄志坚, 何建国.鲑点石斑鱼细菌病原的分离鉴定和致病性[J].中山大学学报 (自然科学版) 2002, 41:64-67.
- 鄢庆枇, 王军, 苏永泉, 皮灵宝, 刘成荣.2001.大黄鱼病原菌———溶藻弧菌的ELISA快速检测研究.海洋科学, 25 (9) :47~49
- 宋晓玲, 黄, 史成银.2001.溶藻弧菌单克隆抗体的制备及应用.水产学报, 25 (6) :522~527
- Sparagano, O.A., Robertson, P.A., Purdom, I.etal.2002.PCRandmoleculardetectionofdifferentiatingVibriospecies.Ann.N.Y.Acad.Sci.Oct.969:60~65.
- 邓佩韦,郑双芝,严晗,等.杭州市水产品中溶藻弧菌耐药表型及耐药基因分布特征[J/OL].食品与发酵工业,1-9[2024-09-19].https://doi.org/10.13995/j.cnki.11-1802/ts.039216.
.png)
