1.约翰逊不动杆菌(Acinetobacter johnsonii)
物种名:约翰逊不动杆菌
拉丁学名:Acinetobacter johnsonii
分类学地位: 细菌界Bacteria;变形菌门Proteobacteria;
γ-变形菌纲Gamma-Proteobacteria;肠杆菌目Enterobacteriales;
莫拉菌科Moraxella family;不动杆菌属Acinetobacter
约翰逊不动杆菌(Acinetobacter johnsonii)是一种属于不动杆菌属的革兰氏阴性杆菌。这种细菌广泛存在于自然界和医院环境中,尤其是在医院环境中经常作为机会性病原体引起感染。
1.1生物学特性
1.1.1培养特征
约翰逊不动杆菌在适宜的培养条件下,如35~37℃、pH 7.0-7.5的环境中,能够在多种培养基上生长。在琼脂平板上,该菌形成的菌落通常较小,圆形,边缘整齐,表面光滑且湿润(图1)。
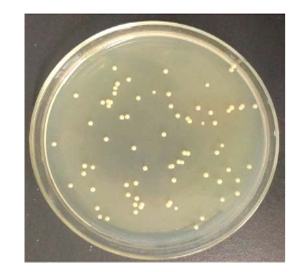
图1 约翰不动杆菌菌落形态[1]
1.1.2形态学特征
在光学显微镜下,约翰逊不动杆菌呈现散在排列,无芽孢,呈现为短杆状,革兰氏阴性(图2)。
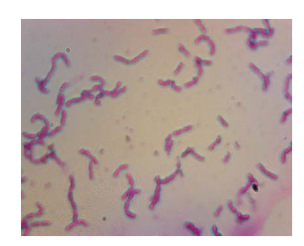
图2 约翰不动杆菌革兰氏染色[1]
在SEM电镜下观察,约翰逊不动杆菌呈杆状,直或稍弯,无芽孢、无荚膜,通常不具有鞭毛,因此不运动(图3)。
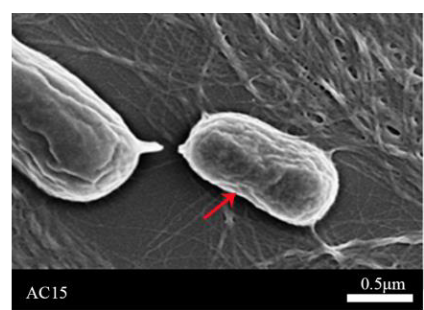
图3 约翰不动杆菌AC15电镜图像[2]
1.1.3生化特征
约翰逊不动杆菌能够发酵多种糖类,产生酸但不产生气体。此外,该菌还具有多种酶类,如尿素酶、氧化酶等。值得注意的是,约翰逊不动杆菌对多种抗生素具有耐药性。
1.1.4 分子生物学特征
(1)毒力因子
约翰逊不动杆菌能够产生多种毒力因子: 外膜蛋白 Outer membrane protein A(OmpA)[3,4]、脂多糖 Lipopolysaccharide(LPS)[5,6] 、外膜囊泡 Outer membrane vesicle ( OMVs)[7]、荚膜多糖[8]、磷脂酶 Phospholipase(PLC and PLD)[9]、青霉素结合蛋白 Penicillin-binding protein(PBPs)、 铁摄取系统[10,11]。
(2)耐药机制
约翰逊不动杆菌对多种抗生素的耐药性是其重要的生物学特征之一。该菌能够通过多种机制获得耐药性,如产生抗生素灭活酶、改变抗生素作用靶点、降低抗生素通透性等。
1.2分布、传播与致病性
1.2.1 分布与传播
约翰逊不动杆菌在自然环境中广泛分布,特别是在水体和土壤中。这种细菌具有很强的粘附力,容易在潮湿的环境中生存,例如在浴盆、肥皂盒等处都能找到它的踪迹。此外,约翰逊不动杆菌也存在于健康人的皮肤上,大约占皮肤微生物群的25%。同时,它还能在咽部、结膜、唾液、胃肠道及阴道分泌物中找到。这意味着人体自身可以成为该菌的储存库,从而成为潜在的感染源。
感染约翰逊不动杆菌的来源可以是患者自身(内源性感染),也可以是其他不动杆菌感染者或带菌者。特别是双手带菌的医务人员,在接触患者时可能成为重要的传播媒介。由于约翰逊不动杆菌在环境中的广泛存在和强粘附性,它很容易通过接触传播。例如,患者可能通过与被污染的医疗器械、床单、衣物等物品的接触而感染。在医院环境中,尤其是在通风不良的区域,约翰逊不动杆菌有可能通过空气传播。特别是在进行某些医疗操作时,如吸痰、雾化等,可能产生含有该菌的气溶胶,从而增加感染风险。
1.2.2 致病性
约翰逊不动杆菌(Acinetobacter johnsonii)的致病性与其毒力因子、感染途径以及宿主的免疫状态等因素密切相关。以下是对约翰逊不动杆菌致病性的详细介绍:
(1)约翰逊不动杆菌能够产生多种毒力因子,这些毒力因子有助于细菌黏附、营养获取和宿主免疫逃逸。这些毒力因子包括但不限于外膜蛋白、脂多糖、胞外酶等。这些物质能够与宿主细胞受体结合,促进细菌在宿主细胞内的存活和复制,进而引发感染。
(2)约翰逊不动杆菌的感染途径主要包括接触传播和空气传播。在医院环境中,由于医疗器械、床单、衣物等物品的污染,以及空气流通不良,该菌容易通过接触和空气传播给易感人群。此外,约翰逊不动杆菌还可以通过侵入性医疗操作,如吸痰、雾化等,产生含有该菌的气溶胶,从而增加感染风险。
(3)宿主的免疫状态对约翰逊不动杆菌的致病性有重要影响。老年人、早产儿和新生儿、手术创伤患者、严重烧伤患者、气管切开或插管患者、使用人工呼吸机患者、行静脉导管和腹膜透析患者,以及广谱抗菌药物或免疫抑制剂应用者等都是该菌的易感人群。这些人群的免疫功能较弱,无法有效清除体内的约翰逊不动杆菌,从而导致感染的发生。
(4)约翰逊不动杆菌可引起多种感染,如呼吸道感染、伤口感染、泌尿道感染等。感染症状因感染部位和个体差异而异,但通常包括发热、咳嗽、呼吸困难、伤口红肿、疼痛、尿液浑浊等。严重感染可能导致脓毒症、休克甚至死亡。
1.3检测方法
(1)显微镜检查
临床标本采集后,首先进行涂片,经过革兰染色后在显微镜下观察。约翰逊不动杆菌为革兰阴性球杆菌,常成双排列,并可能在吞噬细胞内存在。然而,应注意它可能会与其他革兰阴性菌混淆,如奈瑟菌属细菌。
(2)分离培养
为了分离约翰逊不动杆菌,通常会在血平板和麦康凯平板上进行培养。在35-37℃的温度下培养18-24小时后,该菌会在平板上形成圆形、灰白色、光滑、湿润、边缘整齐的菌落,直径约为2-3mm,并不产生色素。值得注意的是,某些约翰逊不动杆菌可能在特定的培养条件下呈现不同的菌落特征。
(3)生化试验
生化试验可以帮助进一步鉴定约翰逊不动杆菌。这些试验可能包括氧化酶试验、动力试验和硝酸盐还原试验等,通常约翰逊不动杆菌在这些试验中会呈现阴性结果。
(4)药敏试验
由于约翰逊不动杆菌通常对多种抗生素具有耐药性,因此进行药敏试验至关重要。药敏试验可以指导临床医生选择有效的抗生素来治疗感染。常用的药敏试验方法包括 Kirby-Bauer法。
(5)分子生物学方法
在某些情况下,可能还需要使用分子生物学方法来检测约翰逊不动杆菌,如PCR、基因测序等。这些方法可以提供更精确、更快速的鉴定结果,特别是在面对复杂或难以鉴定的样本时。
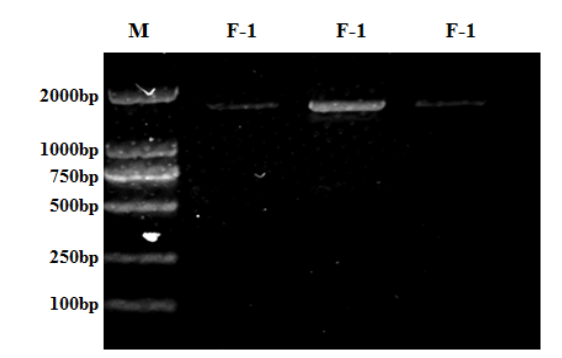
图4 约翰不动杆菌PCR产物凝胶电泳图[1]
1.4典型案例
在某医院的新生儿科,发生了一起由鼠伤寒沙门氏菌和约翰逊不动杆菌共同引起的感染爆发。多名新生儿相继出现发热、腹泻和败血症等症状。经过调查,发现感染源可能来自于一名产妇,她在入院前即为鼠伤寒沙门氏菌和约翰逊不动杆菌的带菌者。由于医院在分娩过程中未能做好消毒隔离工作,导致病原菌传染给了新生儿。此次感染爆发提醒我们,对于产妇等潜在感染源的筛查和管理至关重要,同时医院应加强对新生儿科的消毒隔离工作,以降低感染风险。
在某医院的重症监护室(ICU)中,一名长期使用呼吸机的患者发生了呼吸机相关性肺炎(VAP)。经过实验室检测,确认感染的病原体为约翰逊不动杆菌。该患者由于长期卧床、免疫力低下等因素,容易感染此类病原菌。此次感染提醒我们,对于长期使用呼吸机的患者,应定期监测呼吸机管道和雾化器的清洁度,并及时更换。同时,加强患者的营养支持、提高免疫力等措施也有助于预防呼吸机相关性肺炎的发生。
1.5防治对策
(1)环境卫生管理:保持医院环境的清洁和卫生是预防约翰逊不动杆菌感染的关键。定期清洁和消毒医疗器械、病房、手术室等场所,确保环境表面的无菌状态。同时,加强通风换气,保持空气流通,减少细菌在空气中的传播。
(2)手部卫生:医务人员的手部卫生是防止病原菌传播的重要措施。医务人员应遵守手部卫生规范,勤洗手、使用手消毒剂,特别是在接触患者前后、进行医疗操作前等关键时刻。
(3)患者隔离与保护:对于免疫系统较弱的患者,尤其是易感人群,应采取隔离措施,减少与外界的接触。同时,加强患者的营养支持、提高免疫力等措施,有助于降低感染风险。
参考文献
[1] 马丹. 菲降解约翰逊不动杆菌(Acinetobacter johnsonii) F-1筛选、降解功能及应用[D]. 兰州理工大学, 2018.
[2] 唐明凤. 纳米聚苯乙烯影响不动杆菌毒力研究[D]. 重庆三峡学院, 2023.
[3] Choi C H, Lee E Y, Lee Y C, et al. Outer membrane protein 38 of Acinetobacter baumannii localizes to the mitochondria and induces apoptosis of epithelial cells[J]. Cellular Microbiology, 2005, 7(8): 1127–1138.
[4] Choi C H, Hyun S H, Lee J Y, et al. Acinetobacter baumannii outer membrane protein A targets the nucleus and induces cytotoxicity[J]. Cellular Microbiology, 2008, 10(2): 309–319.
[5] Differential Roles of CD14 and Toll-like Receptors 4and 2 in Murine Acinetobacter Pneumonia[EB/OL]. [2024-02-20] .doi:10.1164/rccm.200505-730OC.
[6] Erridge C, Moncayo-Nieto O L, Morgan R, et al. Acinetobacter baumannii lipopolysaccharides are potent stimulators of human monocyte activation via Toll-like receptor 4 signalling[J]. Journal of Medical Microbiology, 2007, 56(2): 165–171.
[7] Ellis T N, Kuehn M J. Virulence and Immunomodulatory Roles of Bacterial Outer Membrane Vesicles[J]. Microbiology and Molecular Biology Reviews : MMBR, 2010, 74(1): 81–94.
[8] Russo T A, Luke N R, Beanan J M, 等. The K1 Capsular Polysaccharide of Acinetobacter baumannii Strain 307-0294 Is a Major Virulence Factor[J]. Infection and Immunity, 2010, 78(9): 3993–4000.
[9] Tomaras A P, Dorsey C W, Edelmann R E, et al. Attachment to and biofilm formation on abiotic surfaces by Acinetobacter baumannii: involvement of a novel chaperone-usher pili assembly system[J]. Microbiology, 2003, 149(12): 3473–3484.
[10] Mihara K, Tanabe T, Yamakawa Y, et al. Identification and transcriptional organization of a gene cluster involved in biosynthesis and transport of acinetobactin, a siderophore produced by Acinetobacter baumannii ATCC 19606T[J]. Microbiology, 2004, 150(8): 2587–2597.
[11] Iron acquisition functions expressed by the human pathogen Acinetobacter baumannii | BioMetals[EB/OL]. [2024-02-20] .https://link.springer.com/article/10.1007/s10534-008-9202-3.
.png)
