1.阿氏肠杆菌(Enterobacter asburiae)
物种名:阿氏肠杆菌
拉丁学名:Enterobacter asburiae
分类学地位:细菌界Bacteria;变形菌门Proteobacteria;
伽马变形菌Gammaproteobacteria;肠杆菌目Enterobacterales;
肠杆菌科Enterobacteriaceae;肠杆菌属Enterobacter;
阿氏肠杆菌是革兰氏阴性细菌,隶属于变形菌门的伽马变形菌纲。这种细菌在自然环境中广泛存在,尤其是在水体和土壤中。阿氏肠杆菌在水产养殖中是一个重要的病原体,能够引起鱼类的多种疾病,如败血症、皮肤溃疡和出血性疾病,对养殖业造成经济损失。它还能通过食物链传播给人类,可能引起食源性疾病。1986年,Farmer等人在研究一种新型的肠杆菌群时首次描述了阿氏肠杆菌,并将其从原来的“Enteric Group 17”分离出来,命名为Enterobacter asburiae。这一发现填补了肠杆菌科中一类特定细菌的空白,并开启了对其生物学特性及其在自然界中作用的进一步研究[1]。
1.1 生物学特性
1.1.1 培养特征
阿氏肠杆菌可以在多种实验室培养基[2]上生长,阿氏肠杆菌在麦康凯琼脂培养基上形成粉红色菌落(图1);在血琼脂培养基上通常形成无溶血现象的灰白色菌落;在伊红美蓝琼脂上形成深紫色到黑色的菌落,有时伴有金属光泽。
阿氏肠杆菌在温度范围广泛的条件下生长良好,最适生长温度为25°C至37°C。这种温度范围涵盖了许多自然环境和人体环境的温度,使得该菌能够在不同的宿主和环境中存活。作为一种兼性厌氧菌,阿氏肠杆菌能够在有氧和无氧条件下生长,这进一步增强了其在多种环境中的生存能力。
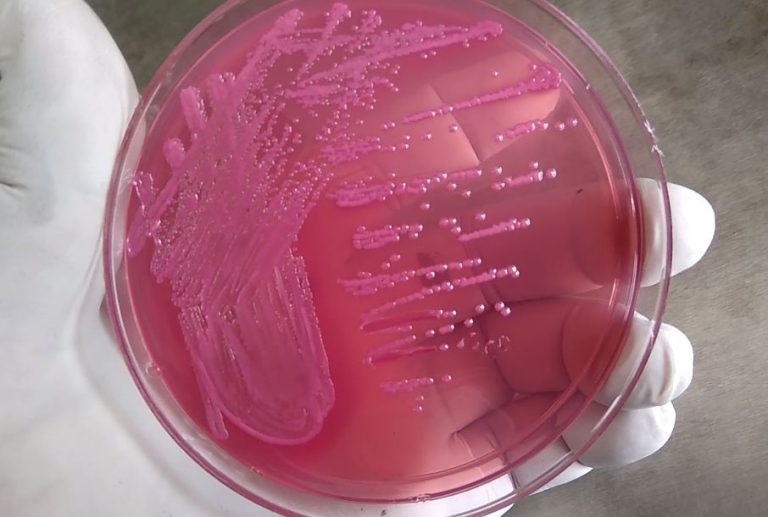
图1 阿氏肠杆菌在麦康凯琼脂培养基上的菌落形态
1.1.2 形态学特征
阿氏肠杆菌在显微镜下呈现为短杆状细菌,革兰氏染色呈阴性,通常长度为1-2 μm,直径约为0.5 μm。其细胞周围分布有鞭毛,这赋予了它在液体环境中的运动能力,帮助它在宿主组织中扩散和定植。阿氏肠杆菌不形成孢子,这意味着它在不利条件下的生存能力可能依赖于其他适应机制,如形成生物膜或进入静息状态[3]。阿氏肠杆菌在光学显微镜和扫描电镜下形态特征见图2。
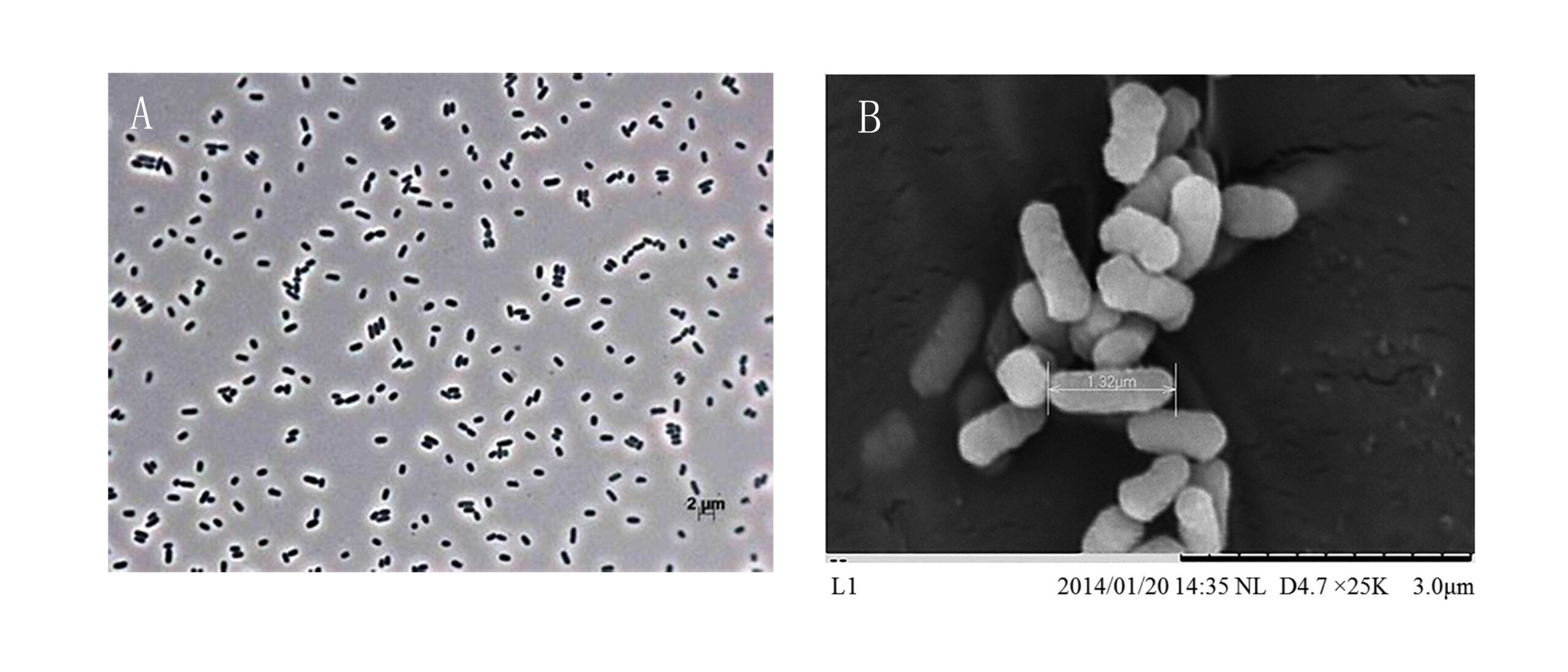
图2 阿氏肠杆菌的形态学特征
A 阿氏肠杆菌在光学显微镜下的照片[4] B 阿氏肠杆菌在扫描电镜下的照片[5]
1.1.3 生化特征
阿氏肠杆菌展示了广泛的生化反应特征,这使其能够适应不同的环境条件,并在不同的生态位中生存和繁殖。以下是阿氏肠杆菌的主要生化特征[1]:催化酶阳性[6]、氧化酶阴性、乳糖发酵阳性、柠檬酸盐利用阳性。
1.1.4 分子生物学特征
在分子生物学水平上,阿氏肠杆菌的基因组已经被广泛研究,其基因组大小约为4.5-5.5 Mb,包含大约4000至5000个编码基因。以下是阿氏肠杆菌的分子生物学特征的详细描述[5]:
16S rRNA基因序列分析:阿氏肠杆菌的16S rRNA基因序列分析是其分类和鉴定的关键工具。16S rRNA基因是一种高度保守的基因,其序列可以用于确定细菌的分类地位和进化关系。阿氏肠杆菌的16S rRNA基因与肠杆菌属的其他成员(如Enterobacter cloacae)有较高的相似性,但也具有足够的差异性,能够将其从其他近缘菌株中区分开来。
基因组结构:阿氏肠杆菌的基因组主要由一个环状染色体组成,此外还可能携带一个或多个质粒。质粒常携带与抗生素耐药性或毒力相关的基因,这使得阿氏肠杆菌在医院环境中的传播和感染更加复杂。
耐药性基因[7]:阿氏肠杆菌在其基因组中常携带多种耐药性基因,特别是编码β-内酰胺酶(如CTX-M、TEM、SHV型)的基因。这些酶能够水解广谱β-内酰胺类抗生素,使得阿氏肠杆菌对这些抗生素表现出耐药性。此外,氨基糖苷修饰酶(如AAC、ANT)和多种外排泵系统(如AcrAB-TolC)的基因也普遍存在于阿氏肠杆菌中,这些基因通过不同机制增强了该菌对多种抗生素的耐受能力。
毒力因子基因:阿氏肠杆菌还携带一些与毒力相关的基因,如编码鞭毛蛋白、脂多糖(LPS)和外膜蛋白的基因。这些毒力因子在阿氏肠杆菌的致病性中起着重要作用。例如,LPS是革兰氏阴性菌的外膜成分,能够诱导宿主的强烈免疫反应,导致炎症反应和组织损伤。
生物膜形成能力:阿氏肠杆菌具备形成生物膜的能力,这在医院环境中特别具有重要意义。生物膜由细菌群体及其分泌的黏附物质组成,能够附着在医疗器械、导管及宿主组织上。生物膜形成使得细菌对抗生素和宿主免疫系统的抵抗能力显著增强,从而增加了感染的持续性和治疗的难度。
1.2 分布、传播与致病性
1.2.1 分布与传播
阿氏肠杆菌的分布范围广泛[8],其在环境中的生存能力使得它能够通过多种途径传播:
自然环境中的分布:阿氏肠杆菌主要存在于土壤、水体和植物表面。它能够在这些环境中形成稳定的群落,参与有机物的分解和营养循环。在农业生态系统中,阿氏肠杆菌可能与植物根系共生,帮助植物吸收营养,并可能在某些情况下促进植物生长。
人类和动物体内的分布:阿氏肠杆菌也存在于人类和动物的肠道微生物群中。作为一种条件致病菌,阿氏肠杆菌在正常情况下不会引发疾病,但在宿主免疫系统受损或菌群失衡时,它可能引发感染。阿氏肠杆菌通过粪口途径在人群和动物之间传播,特别是在卫生条件不佳的环境中,这一传播途径尤为显著。
医院环境中的传播:阿氏肠杆菌在医院环境中尤为常见,特别是在ICU等高风险区域。由于其对多种抗生素的耐药性,它在医院中的传播能力尤为显著。阿氏肠杆菌可以通过医疗器械(如导尿管、呼吸机)、医务人员的手和污染的表面传播。这种院内传播可能导致难以控制的感染暴发,尤其是在免疫抑制患者中。
1.2.2 致病性
阿氏肠杆菌是一种条件致病菌,其致病性主要体现在免疫功能受损的个体中。以下是阿氏肠杆菌引发的主要感染类型:
尿路感染(Urinary tract infection,UTI):这是阿氏肠杆菌最常见的感染类型之一,尤其在使用导尿管的患者中。尿路感染的症状包括排尿困难、尿频、尿急和血尿等。阿氏肠杆菌引发的尿路感染可能发展为上行性感染,导致肾盂肾炎等严重并发症。
肺炎[9]:阿氏肠杆菌可引发医院获得性肺炎,特别是在使用机械通气的患者中。肺炎的症状包括咳嗽、呼吸困难、发热和胸痛等。在某些情况下,阿氏肠杆菌引发的肺炎可能导致肺部空洞形成,增加治疗的难度和并发症的风险。
败血症:当阿氏肠杆菌通过血液扩散至全身时,可能引发败血症。这种情况在免疫功能低下的患者中尤为严重,常表现为全身炎症反应综合征(SIRS)、多器官功能衰竭,甚至死亡。败血症是阿氏肠杆菌感染中最为危急的情况之一,通常需要立即进行广谱抗生素治疗和支持性护理
伤口感染:阿氏肠杆菌可引发术后或创伤后的伤口感染,表现为伤口红肿、疼痛、化脓和愈合不良。在一些情况下,感染可能扩散至周围组织,导致蜂窝织炎或脓毒症
近年来,阿氏肠杆菌因其多重耐药性而引起了广泛关注。多重耐药菌株(MDR)的出现使得传统的抗生素治疗无效,增加了感染治疗的复杂性和成本。在医院环境中,这种多重耐药性菌株的传播可能导致严重的院内感染暴发,给公共卫生带来重大挑战。
1.3 检测方法
阿氏肠杆菌的检测方法涵盖了传统的培养和生化测试以及现代分子生物学技术。这些方法的结合使用有助于快速、准确地鉴定阿氏肠杆菌,并为临床治疗提供指导。
传统培养和生化测试:通过选择性培养基(如麦康凯琼脂和伊红美蓝琼脂)可以分离和初步鉴定阿氏肠杆菌。结合生化测试(如催化酶测试、氧化酶测试、靛基质测试等)可以进一步确认其生化特性,并与其他肠杆菌属成员区分开来
PCR(聚合酶链式反应):PCR技术是检测阿氏肠杆菌特异性基因片段的快速、敏感的方法,特别是在检测耐药基因时具有重要意义。PCR可以扩增并检测与抗生素耐药性相关的基因,如β-内酰胺酶基因(CTX-M、TEM、SHV型),从而提供耐药性的信息,有助于选择合适的抗生素治疗方案
基因组测序:全基因组测序技术能够提供阿氏肠杆菌基因组的全面信息,帮助识别其耐药基因和毒力因子。这一技术可以用于追踪院内感染暴发的源头,并分析不同菌株之间的进化关系。
多位点序列分型(MLST):MLST是一种用于分析不同菌株之间遗传关系的分子分型方法,通过分析七个保守基因的序列变异,可以区分不同的克隆型。这一技术在流行病学研究和源头追踪中具有重要应用价值。
质谱分析:MALDI-TOF质谱是一种现代的细菌鉴定方法,通过分析细菌蛋白质指纹图谱可以快速鉴定阿氏肠杆菌及其耐药性。这一技术在医院实验室中已得到广泛应用,能够在数分钟内提供鉴定结果。
1.4 典型案例
肺炎合并空洞形成:一位免疫抑制患者因阿氏肠杆菌感染导致肺炎,并在影像学检查中发现肺部空洞。该患者对多种抗生素表现出耐药性,治疗过程中需要使用广谱抗生素和长时间的机械通气支持。这一案例强调了阿氏肠杆菌在免疫受损个体中的高度致病性以及其多重耐药性对治疗的影响。
医院感染暴发:在一家医院的ICU病房中,阿氏肠杆菌引发了多例院内感染,涉及多名重症患者。通过分子分型分析,研究人员发现这些感染来自于同一克隆型菌株,提示了该菌株通过污染的呼吸设备和导尿管传播。这一案例展示了在医院环境中阿氏肠杆菌的传播能力以及在感染控制中的挑战。
食品中毒事件:某地区爆发了一起由阿氏肠杆菌引起的食品中毒事件,主要源头为受污染的蔬菜和乳制品。该事件导致数十人出现胃肠道不适,表现为腹泻、呕吐和发热。实验室分析显示,阿氏肠杆菌在不当储存条件下快速繁殖,并通过食物链传播至消费者。这一案例突出了在食品安全和卫生方面的潜在隐患。
1.5 防治对策
为有效防治阿氏肠杆菌感染,特别是在医院和食品加工环境中,需要采取综合性的防治策略。这些策略应包括感染控制、合理使用抗生素以及新药研发等多个方面。
1.5.1 感染控制措施
手卫生:加强医务人员的手卫生培训和监督,确保在接触患者和医疗器械之前和之后进行彻底的手部清洁。手卫生是防止院内感染传播的最重要措施之一。
医疗器械管理:确保所有医疗器械在使用前后进行适当的消毒和灭菌,特别是在ICU等高风险区域。一次性使用的医疗器械应避免重复使用,以防止交叉感。
环境清洁:定期对医院环境中的高接触表面(如门把手、床栏、呼吸机等)进行清洁和消毒,尤其是在院内感染暴发期间。
隔离措施:对于确诊或疑似阿氏肠杆菌感染的患者,应采取隔离措施,防止其与其他患者接触。隔离措施可以有效减少细菌在医院环境中的传播。
1.5.2 合理使用抗生素
抗生素管理:建立合理的抗生素使用规范,根据药敏试验结果选择合适的抗生素,避免不必要的广谱抗生素使用。抗生素管理计划(ASP)可以帮助减少抗生素耐药性的发展。
抗生素轮替使用:定期轮换使用不同种类的抗生素,避免长期使用同一类抗生素导致耐药菌株的选择压力增加。
1.5.3 新药研发与疫苗开发
新型抗菌药物:由于阿氏肠杆菌的多重耐药性问题,迫切需要研发新型抗菌药物。这些药物应具有新的作用机制,以克服现有抗生素的耐药性。
疫苗开发:目前尚无针对阿氏肠杆菌的特异性疫苗,但在高风险人群(如免疫抑制患者)中,疫苗开发可能是一种有效的预防策略。未来的研究应集中于识别和鉴定阿氏肠杆菌的抗原靶点,开发有效的疫苗来预防其感染。
参考文献
[1] BRENNER D J, MCWHORTER A C, KAI A, et al. Enterobacter asburiae sp. nov., a new species found in clinical specimens, and reassignment of Erwinia dissolvens and Erwinia nimipressuralis to the genus Enterobacter as Enterobacter dissolvens comb. nov. and Enterobacter nimipressuralis comb. nov [J]. J Clin Microbiol, 1986, 23(6): 1114-1120.
[2] MARDANEH J, SOLTAN DALLAL M M. Isolation and Identification Enterobacter asburiae from Consumed Powdered Infant Formula Milk (PIF) in the Neonatal Intensive Care Unit (NICU) [J]. Acta Med Iran, 2016, 54(1): 39-43.
[3] LAU Y Y, YIN W F, CHAN K G. Enterobacter asburiae strain L1: complete genome and whole genome optical mapping analysis of a quorum sensing bacterium [J]. Sensors (Basel), 2014, 14(8): 13913-13924.
[4] KäMPFER P, MCINROY J A, GLAESER S P. Enterobacter muelleri sp. nov., isolated from the rhizosphere of Zea mays [J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt_11): 4093-4099.
[5] ZHU B, WANG S, LI O, et al. High-quality genome sequence of human pathogen Enterobacter asburiae type strain 1497-78T [J]. Journal of Global Antimicrobial Resistance, 2017, 8(104-105.
[6] RAHI P, MüHLE E, SCANDOLA C, et al. Genome sequence-based identification of Enterobacter strains and description of Enterobacter pasteurii sp. nov [J]. Microbiology Spectrum, 2023, 12(1): e03150-03123.
[7] DAVIN-REGLI A, LAVIGNE J P, PAGèS J M. Enterobacter spp.: Update on Taxonomy, Clinical Aspects, and Emerging Antimicrobial Resistance [J]. Clin Microbiol Rev, 2019, 32(4):
[8] SALIMIYAN RIZI K, GHAZVINI K, FARSIANI H. Clinical and pathogenesis overview of Enterobacter infections [J]. Reviews in Clinical Medicine, 2020, 6(4): 146-154.
[9] CHA SW H J, PARK CK, CHOI YW, JEON SC. Enterobacter Asburiae Pneumonia with Cavitation [J]. J Korean Soc Radiol, 2013, 68(3): 217-219.
.png)
