1. 马红球菌(Rhodococcus equi)
物种名:马红球菌
拉丁学名:Rhodococcus equi
分类学地位:细菌界Bacteria;放线菌门Actinomycetota;
放线菌纲Actinobacteria;放线菌亚纲Actinobacteridae;
放线菌目Actinomycetales;棒杆菌亚目Corynebacterineae;
诺卡菌科Nocardiaceae;红球菌属Rhodococcus
马红球菌(Rhodococcus equi)原称为马棒状杆菌(C.equi),曾归于棒状杆菌属,但近年来国外学者对其细胞壁进行分析后,发现有些棒状杆菌不符合棒状杆菌属的特性,因而1986年出版的《伯杰氏细菌学分类手册》第2卷,建议列入红球菌属,命名为马红球菌。红球菌属中唯一的动物致病种。该菌为马、猪、牛等动物的致病菌,过去引起人类致病极为罕见。
1.1生物学特性
1.1.1培养特征
偏性需氧,10~40℃生长,最适温度28~30℃。在固体培养基上形成边缘整齐、光滑闪光的灰红至橙红色菌落。在马铃薯或牛乳琼脂形成色素更为明显。在血琼脂产生大量粘质,不溶血。常规的培养基为 TSA 平板,培养后菌落形态为呈乳白色,粘液、湿润、有光泽,随着时间的生长呈鲑粉色[2]。
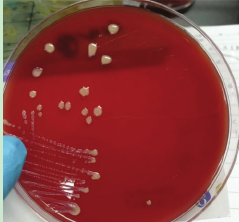
图1 马红球菌在血平板上的培养结果
1.1.2形态学特征
马红球菌均为产生橙黄、橙红色素,菌体呈多形态的革兰阳性杆菌[1]。在葡萄糖酵母膏琼脂上呈丝状但迅即断裂为杆状、球形或多形体。不产生芽胞,无气中菌丝体和分生孢子,无运动性。
1.1.3生化特征
生化反应不活泼,不能发酵任何糖、醇类,触酶呈阳性反应。不产生毒素。氧化酶阴性,不产生靛基质,不液化明胶。分解尿素,还原硝酸盐。
1.1.4 分子生物学特征
青岛市卫生防疫站经过3年的研究发现,该菌体含有ST、LT毒素,并对青霉素、先锋霉素产生耐药性。致病性 R.equi 携带 80~90 kb 的质粒,该质粒存在毒力相关蛋白的基因 VapA 具有主导毒株诱导马驹肺炎的能力[2]。
1.2分布、传播与致病性
1.2.1 分布与传播
马红球菌是红球菌属中唯一的动物致病种,主要来源于土壤,通过吸入和食入感染。它存在于畜粪、地表土、水、瘤胃及肠内[3-5],特别是在肥沃的中性土壤(pH7.3)和马粪中能长期存活,并在温、湿季节大量繁殖。目前马红球菌病传播途径还未明确,普遍认为马红球菌病主要由带有 R. equi 的粉尘进入呼吸道进行感染[6-7]。
1.2.2 致病性
食用不熟的猪、牛、羊肉,特别是食用各种烤肉串常使人致病,并可引起艾滋病、血液病和肾移植等免疫功能受损患者的肺部感染。马红球菌感染又称幼驹传染性支气管肺炎(foal infectious bronchopneumonia)。以1-6月龄幼驹发生化脓性支气管炎为特征。可经消化道和呼吸道感染。病驹在发病初期精神沉郁,食欲减退,时有咳嗽,随后出现稽留高温,结膜潮红,贫血,随着病情的发展,发生化脓性肺炎,呼吸迫促,鼻腔流脓液性分泌物,以后转为脓性。有的病驹关节肿大,最后卧地不起,多因脓毒败血症而死。 本菌还可引起猪的化脓性肺炎和淋巴结炎,牛和绵羊的化脓性肺炎。本菌还可能与人淋巴瘤以及脓用免疫抑制剂患者有关。
1.3检测方法
- 分子生物学法:R.equi 的一个决定性特征是产生胆固醇氧化酶(Cholesterol oxidase,ChoE)利用 PCR 扩增 ChoE 基因可以鉴定是否为 R.equi[2]。
- 血清学检测:确诊马红球菌病也可以使用 ELISA 的方法对病驹致病性R. equi 血清抗体水平检测。
1.4典型案例
虽然马红球菌在动物中普遍存在,但通常不会感染人类。然而,在某些情况下,马红球菌可能会引发人类感染,尤其是当人类与受感染动物密切接触时。关于马红球菌造成的污染或危害事件,目前并没有像其他病原菌那样被广泛报道。这可能是因为马红球菌感染人类的案例相对较少,或者其引起的症状较为轻微,没有引起足够的关注。然而,根据已有的报道和研究,马红球菌感染人类的案例主要发生在与马、牛、羊等动物密切接触的人群中。目前并无大量具体的病例可以表明其与水污染明确相关。
1.5防治对策
- 确保水源地远离可能含有马红球菌的污染源,如畜牧场、农田等。
- 加强对畜牧场的管理,确保动物粪便和废水得到妥善处理,防止其污染水源。
- 在水处理过程中,采用有效的过滤和消毒方法,以去除或杀灭水中的马红球菌。
参考文献
期刊
[1] von Bargen K, Polidori M, Becken U, et al. Rhodococcus equi virulence-associated protein A is required for diversion of phagosome biogenesis but not for cytotoxicity. Infect Immun, 2009, 77(12):5676-5681.
[3] Dillon D, Witten P E, Buck C L. Evaluating Dermal Bone as a Novel Source of Endocrine Information in Ninespine and Threespine Stickleback Fish. Integr Org Biol, 2023, 5(1):obad7.
[4] Kuskie K R, Smith J L, Wang N, et al. Effects of location for collection of air samples on a farm and time of day of sample collection on airborne concentrations of virulent Rhodococcus equi at two horse breeding farms. Am J Vet Res, 2011, 72(1):73-79.
[5] Takai S, Chaffin M K, Cohen N D, et al. Prevalence of virulent Rhodococcus equi in soil from five R. equi-endemic horse-breeding farms and restriction fragment length polymorphisms of virulence plasmids in isolates from soil and infected foals in Texas. J Vet Diagn Invest, 2001, 13(6):489-494.
[6] Chaffin M K, Cohen N D, Martens R J, et al. Foal-related risk factors associated with development of Rhodococcus equi pneumonia on farms with endemic infection. J Am Vet Med Assoc, 2003, 223(12):1791-1799.
[7] Muscatello G, Gilkerson J R, Browning G F. Detection of virulent Rhodococcus equi in exhaled air samples from naturally infected foals. J Clin Microbiol, 2009, 47(3):734-737.
硕士论文
.png)
