1.利什曼原虫(Leishmania)
物种名:利什曼原虫
拉丁学名:Leishmania
分类学地位:原生生物界Protista;眼虫门Euglenozoa;
动质体纲Kinetoplastid;锥虫目Trypanosomatida;
锥虫科Trypanosomatidae;利什曼属Leishmania
利什曼原虫(Leishmania),可在人体导致多种疾病,称为利什曼病(Leishmaniasis),是对人体危害严重的人兽共患寄生虫病,严重危害人体健康。在2000年被世界卫生组织列为重点防治的10种热带病之一。该原虫主要寄生于病人体内的巨噬细胞里,双翅目昆虫白蛉为该病传播媒介。
1.1生物学特性
1.1.1生活史
利什曼原虫生活史有前鞭毛体(Promastigote)及无鞭毛体(Amastigote)两个时期,前者寄生于节肢动物白蛉的消化道内,后者寄生于脊椎动物的单核巨噬细胞内,通过白蛉传播。
在白蛉体内发育:当雌性白蛉叮刺病人或受感染的动物宿主时,血液或皮肤内含无鞭毛体的巨噬细胞被吸入胃内,经24小时,无鞭毛体发育为早期前鞭毛体。此时虫体呈卵圆形,鞭毛也开始伸出体外。48小时后发育为粗短的前鞭毛体或梭形前鞭毛体,体形从卵圆形逐渐变为宽梭形或长度超过宽度3倍的梭形,此时鞭毛亦由短变长。第3、4天出现大量成熟前鞭毛体,长11.3-15.9 μm(有时可达20 μm),活动力明显加强,并以纵二分裂法繁殖。在数量剧增的同时,虫体逐渐向白蛉前胃、食道和咽部移动。一周后具感染力的前鞭毛体大量聚集在口腔及喙。当白蛉叮刺健康人时,前鞭毛体随白蛉唾液进入人体。在离体培养中,可见前鞭毛体分裂繁殖是从原鞭毛附近伸出一根新的鞭毛开始,虫体逐渐变粗短,长度仅为宽的1-2倍。有的虫体先从前端开始纵裂,继之后端也出现裂隙,虫体在中部断裂为两个虫体。也有虫体从前向后顺序裂开,最后在后端断裂为两个虫体。分裂后虫体逐渐变长呈梭形。
在人体内发育:感染有前鞭毛体的雌性白蛉叮刺人体吸血时,前鞭毛体随白蛉分泌的唾液进入人体的皮下组织。一部分前鞭毛体可被多核白细胞吞噬消灭;一部分则进入巨噬细胞。原虫进入巨噬细胞后,逐渐变圆,失去其鞭毛的体外部分,向无鞭毛体期转化。此时巨噬细胞内形成纳虫空泡。无鞭毛体在巨噬细胞内不但可以存活,且能进行分裂繁殖。电镜观察可见无鞭毛体分裂从新鞭毛轴丝形成和动基体DNA纤丝伸长开始,以后DNA纤丝出现裂隙,继之细胞核分裂,虫体一侧表膜出现凹陷,新膜下微管和表膜先后形成,并向细胞内伸入,包绕两个分裂的虫体,完成细胞分裂。无鞭毛体的大量繁殖,最终巨噬细胞破裂。游离的无鞭毛体又进入其他巨噬细胞,重复上述增殖过程[1]。
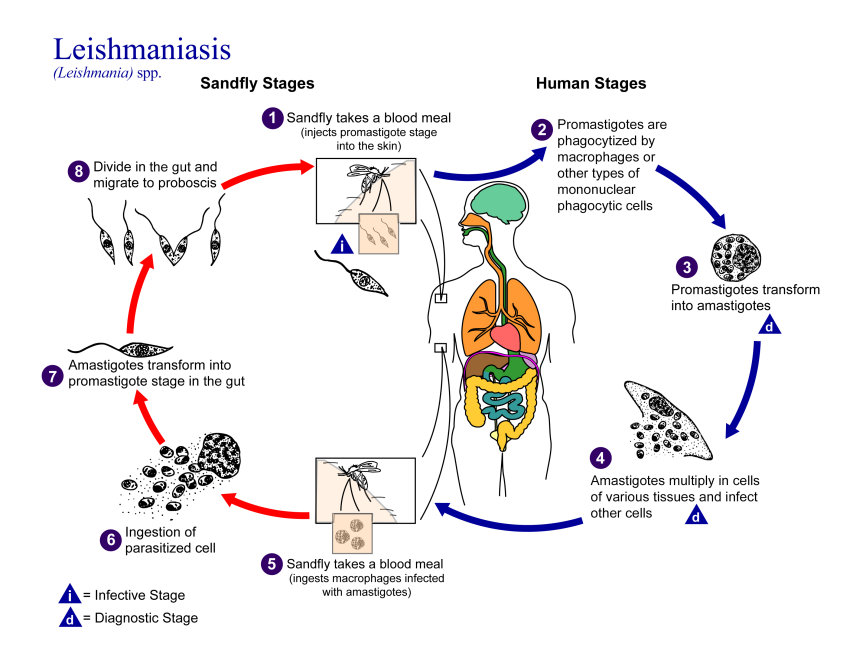
图1 利什曼原虫生活史[2]
1.1.2形态学特征
利什曼原虫属是单细胞真核生物,具有明确的细胞核和其他细胞器,包括动基体(Kinetoplasts)和鞭毛(Flagella)。根据其生命周期的阶段,它们存在两种结构变体。
前鞭毛体寄生于白蛉消化道内。成熟的虫体呈梭形,大小为(14.3-20) μm×(1.5-1.8) μm,细胞核位于虫体中部,动基体在前部。瑞氏染液染色后,细胞质呈淡蓝色,细胞核和动基体呈红色。基体在动基体之前,由此发出一根鞭毛游离于虫体外,为虫体运动器管。前鞭毛体运动活泼,在培养基内常以虫体前端聚集成团,排列成菊花状。前鞭毛体的形态和发育程度有关,可见到粗短形前鞭毛体和梭形前鞭毛体。
无鞭毛体虫体卵圆形,大小为(2.9-5.7) μm×(1.8-4.0) μm,寄生于人和其他哺乳动物的巨噬细胞内。瑞氏染液染色后,细胞质呈淡蓝色,内有一个较大的圆形核,呈红色或淡紫色。动基体位于核旁,着色较深,细小杆状。在高倍镜下有时可见虫体从前端颗粒状的基体发出一条根丝体(Rhizoplast)。基体靠近动基体,在普通光镜下不易区分[3]。
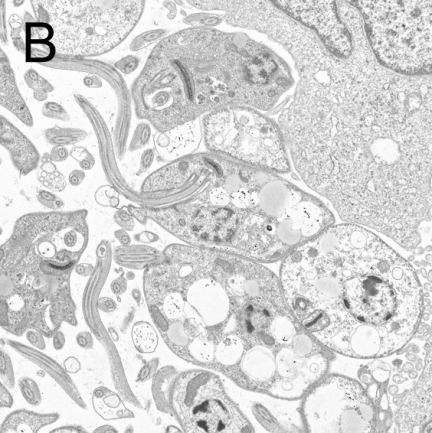
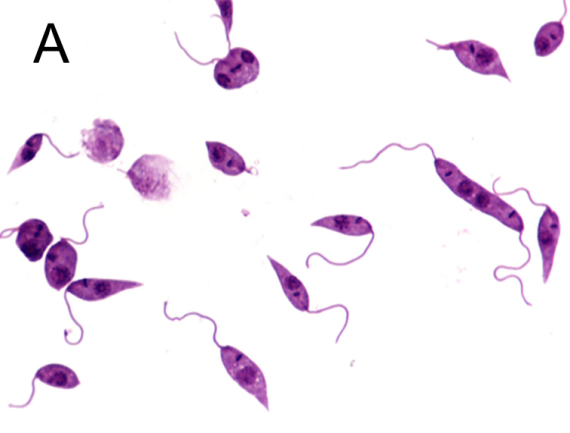
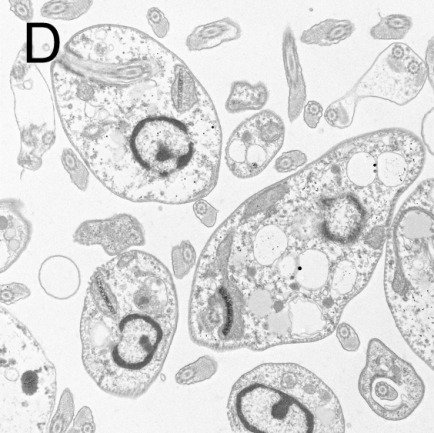
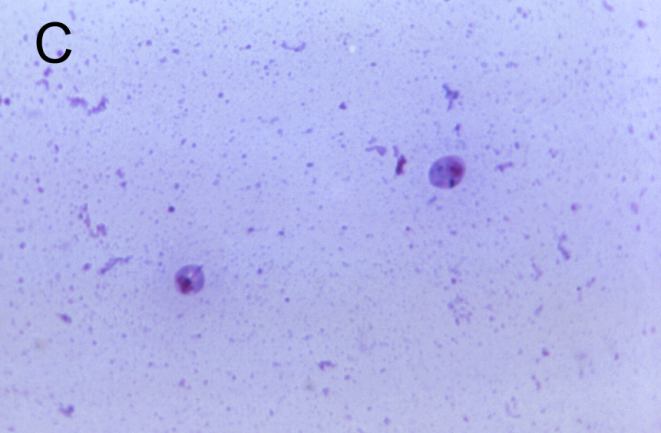
图2 利什曼原虫形态结构
A:前鞭毛体染色显微照片[4],B:前鞭毛体透射电子显微镜照片[5]
C:无鞭毛体染色显微照片[6],D:无鞭毛体透射电子显微镜照片[7]
1.1.3生化特征
利什曼原虫在干燥环境中存活时间较短,尤其在高温低湿度条件下更为显著。其主要致死因素为高温(39℃),且不同菌株(如新旧世界皮肤利什曼原虫)对高温的敏感性存在显著差异[8]。五价锑化合物(Pentavalent antimonials),对利什曼原虫有很强的杀伤作用,包括葡萄糖酸锑钠和葡糖胺锑。
1.2分布、传播与致病性
1.2.1分布与传播
利什曼病广泛分布在亚、非、欧、拉美等洲的热带和亚热带地区,在近88个国家里每年有近百万的人感染利什曼病[9]。
利什曼原虫病的传染源多为病人或者病犬。该病可通过各种白蛉的叮咬传播,包括中华白蛉、长管白蛉等。某些野生动物也可感染利什曼原虫[10]。
1.2.2致病性
30种利什曼原虫可以感染哺乳动物,其中的21种可以感染人类。寄生于皮肤巨噬细胞内引起皮肤利什曼病的有热带利什曼原虫、硕大利什曼原虫、埃塞俄比亚利什曼原虫和墨西哥利什曼原虫;引起黏膜皮肤利什曼病的为巴西利什曼原虫等;寄生于内脏巨噬细胞内引起内脏利什曼病的有杜氏利什曼原虫、婴儿利什曼原虫和恰氏利什曼原虫。中国的黑热病是由杜氏利什曼原虫引起的[9]。
杜氏利什曼原虫的致病机制为无鞭毛体在巨噬细胞内繁殖,使巨噬细胞大量破坏和增生,巨噬细胞增生主要见于脾、肝、淋巴结、骨髓等器官。浆细胞也大量增生。细胞增生是脾大、肝大、淋巴结肿大的根本原因,其中脾大最为常见,也是黑热病最主要的体征,出现率在95%以上。后期则因网状纤维组织增生而变硬。
贫血是黑热病另一重要症状,血液中红细胞、白细胞及血小板都减少,即全血象减少,这是由于脾功能亢进,血细胞在脾内遭到大量破坏所致。此外,免疫溶血也是产生贫血的重要原因。有实验表明,患者的红细胞表面附有利什曼原虫抗原,此外,杜氏利什曼原虫的代谢产物中有1-2种抗原与人红细胞抗原相同,因而机体产生的抗利什曼原虫抗体有可能直接与红细胞膜结合,在补体参与下破坏红细胞造成贫血。
患者血浆内白蛋白明显减少,球蛋白增加,由于肝脏受损,白蛋白合成减少,经尿排出的白蛋白增加,尿蛋白及血尿的出现可能与患者发生肾小球淀粉样变性及肾小球内有免疫复合物的沉积有关。再加上浆细胞大量增生使球蛋白量增加,最终导致白蛋白与球蛋白的比例倒置[3]。
皮肤型利什曼病(Cutaneous Leishmaniasis, CL),其出现的第一个临床表现是白蛉咬伤部位的皮肤病变(通常是质硬的无痛丘疹)。虽然单处的皮肤病变可能看起来症状轻微,但多处皮肤病变或毁容性的面部皮肤病变对患者来说可能是毁灭性的打击。通常,继发性皮肤病变具有相似的外观并以相同的速度发展。原发皮肤病变可能为持续的扁平斑块或可能进展为浅溃疡。随着溃疡扩大,产生渗出液,并常常继发细菌或其他微生物感染。
在黏膜型利什曼病(Mucocutaneous Leishmaniasis, MCL)中,原发病变与皮肤型利什曼病中发现的病变相似。在多达80%的皮肤型利什曼病病例中,未经治疗的原发性皮肤病变可能会发展为黏膜病变。黏膜型利什曼病的活动性原发灶可能会播散至鼻腔或口腔黏膜,也可能在原发灶愈合数年后发生播散。这些黏膜病变不会自愈,继发细菌感染很常见,甚至可能是致命的。黏膜型利什曼病主要见于巴西、玻利维亚和秘鲁。
内脏型利什曼病(visceral leishmaniasis, VL),也称为黑热病,潜伏期从10天到2年不等,但通常为2-4个月。常见症状包括发热、厌食、乏力、体重减轻,并且经常出现腹泻。临床症状包括无触痛的肝脾大,淋巴结肿大和偶发的急性腹痛。在印度,在肤色较浅的患者中常见面部、手部、足部和腹部的皮肤变黑。慢性病例可能会在几周后或2-3年后死亡。大多数感染者没有症状,或者只有很少或轻微的症状,无需治疗即可恢复。自1990年以来,器官移植受者的利什曼病发病率有所增加。这些病例大多数都是内脏型利什曼病[11]。
1.3检测方法
- 病原学检查:对疑似内脏利什曼病患者采集骨髓、疑似皮肤利什曼病患者取皮肤组织液制作涂片,用吉氏或瑞氏染液染色,在光学显微镜(100×油浸物镜、10×目镜)下镜检。涂片中查到无鞭毛体为阳性,观察1000个以上视野未发现则为阴性,同时需与荚膜组织胞浆菌鉴别[12]。
- 分子生物学方法:Kobets等提出了一种改进的PCR-ELISA方法,通过双标记引物(digoxigenin和biotin)结合ELISA技术,显著提高了利什曼原虫的检测灵敏度和通量。该方法靶向动基体小环DNA(kDNA)的保守区域,可检测多种利什曼原虫(如L.major、L.donovani等),灵敏度达0.3 fgDNA/反应(约0.004个寄生虫),适用于宿主组织中的病原体定量分析[13]。
表1 利什曼原虫PCR-ELISA引物序列
| 引物名称 | 标记 | 序列 |
| F | Digoxigenin | 5′-ATTTTACACCCACCCCCAGTT-3′ |
| R | Biotin | 5′-GTGGGCGAGGGGCGTTCT-3′ |
1.4典型案例
世界卫生组织(WHO)发布的技术报告《Control of the leishmaniases》指出利什曼原虫传播与水环境(积水、湿度、河流生态)存在间接关联。白蛉幼虫需在富含有机物的潮湿环境(如水源附近湿润土壤、雨季积水区)发育,成虫喜聚集于水源旁高湿度区域。灌溉工程、森林砍伐等致局部湿度升高,可扩大白蛉孳生地,如埃塞俄比亚灌溉区、巴西河流域病例与湿润环境密切相关,雨季积水更会引发疫情季节性升高[14]。
1.5防治对策
在利什曼原虫病流行区,防控需采取多环节联动策略:及时使用病原检查或血清学方法查出病犬,并进行处理;当发现人类病例时,可用杀虫剂喷病人住家及其四周半径15 m之内的住屋和畜舍,以歼灭停留在室内或自野外入侵室内吸血的白蛉。同时,推广使用经2.5%溴氰菊酯浸泡处理的蚊帐(每季浸药一次)和同浓度药液预处理的细孔纱门纱窗,通过物理屏障与药物驱避双重作用降低蚊、蛉叮咬风险。在疫区内,可在白蛉季节内用2.5%溴氰菊酯药浴或喷淋犬体,以杀死或驱除前来刺叮吸血的白蛉。此外,对夜间野外作业人员需强化个体防护,在裸露皮肤涂抹驱避剂以形成化学屏障,避免白蛉接触感染[10]。
参考文献
[1] 李巧丽. 杜氏利什曼原虫两个发育阶段基因表达系列分析文库的构建及HSP90在其阶段转变过程中的作用. 上海交通大学, 2009.
[2] https://phil.cdc.gov/Details.aspx?pid=3400.
[3] 夏超明, 彭鸿娟. 人体寄生虫学. 北京: 中国医药科技出版社, 2016.
[4] https://healthjade.com/wp-content/uploads/2018/10/Leishmania-donovani.jpg.
[5] https://phil.cdc.gov/Details.aspx?pid=22000.
[6] https://phil.cdc.gov/Details.aspx?pid=21110.
[7] https://phil.cdc.gov/Details.aspx?pid=22001.
[8] Sacks DL, Barral A, Neva FA. Thermosensitivity patterns of Old vs. New World cutaneous strains of Leishmania growing within mouse peritoneal macrophages in vitro. Am J Trop Med Hyg, 1983, 32: 300-304.
[9] 刘尔翔, 王恒. 中华医学百科全书 基础医学 医学寄生虫学. 北京: 中国协和医科大学出版社, 2023.
[10] 张磊, 张灵君, 张雪梅. 动物防疫技术与人畜共患病知识问答. 济南: 山东友谊出版社, 2023.
[11] 帕特里夏·M.蒂尔, 胡必杰, 潘珏. 贝勒和斯科特诊断微生物学. 上海: 上海科学技术出版社, 2023.
[12] WS/T 10018-2024 利什曼原虫检测涂片镜检法. 国家疾病预防控制局, 2024.
[13] Kobets T, Badalová J, Grekov I et al. Leishmania parasite detection and quantification using PCR-ELISA. Nat Protoc, 2010, 5: 1074-1080.
[14] World Health Organization. Control of the leishmaniases: report of a meeting of the WHO Expert Committee on the Control of Leishmaniases. WHO Technical Report Series. 2010, 949.
.png)
