1.比氏肠微孢子虫(Enterocytozoon bieneusi)
物种名:比氏肠微孢子虫
拉丁学名:Enterocytozoon bieneusi
分类学地位:真菌界Fungi;微孢子虫门Microsporidia;
微孢子虫纲Microsporea;微孢子虫目Microsporidia;
无膜泛成孢子虫亚目Apanspor oblastina;
肠孢子虫科Enterocytozoonidae;肠孢子虫属Enterocytozoon
比氏肠微孢子虫(Enterocytozoon bieneusi)是一种新发人兽共患肠道原虫,可感染人和多种动物。主要通过粪口途径传播,能导致免疫妥协或免疫低下者长期的致死性腹泻,也能够导致免疫功能正常者剧烈的自限性腹泻。1985年,在长期腹泻的艾滋病人体内首次发现比氏肠微孢子虫,导致艾滋病病人持续性腹泻,并危及生命。
1.1生物学特性
1.1.1生活史
比氏肠微孢子虫是否存在有性生殖阶段尚不明确,其生活史大致包括:呈卵块发育的原形体阶段、呈孢子生殖的原形体阶段、孢子母细胞阶段和孢子阶段,这4个阶段均与宿主细胞质直接接触。孢子侵入细胞时伸出极管穿入宿主细胞,将孢子质通过中空的极管注入宿主细胞胞质内。孢子质在靠近宿主细胞核的空泡内通过裂体增殖和孢子增殖,发育为孢子。孢子从破裂的宿主细胞中释放并随粪便排到外界环境,被其他宿主摄入并传播[1]。
1.1.2形态学特征
比氏肠微孢子虫的孢子大小约为0.9×1.5 μm,卵圆形,无鞭毛,染色时有特殊的外观。孢子壁染成亮粉红色;有些孢子透明,另一些则呈明显的粉红色带状条纹,呈对角线或赤道线环绕孢子。粪便标本中的大多数背景碎片复染为淡绿色[2]。
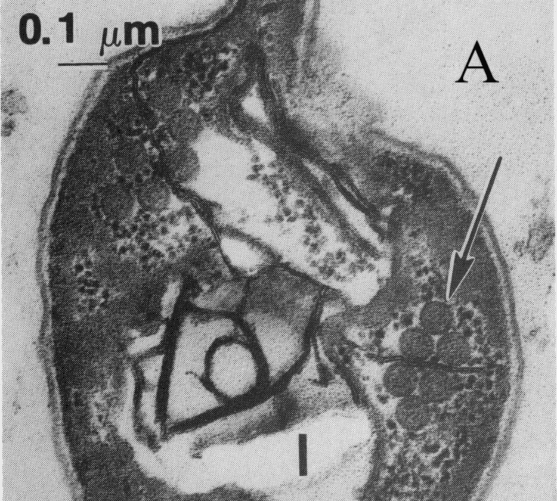
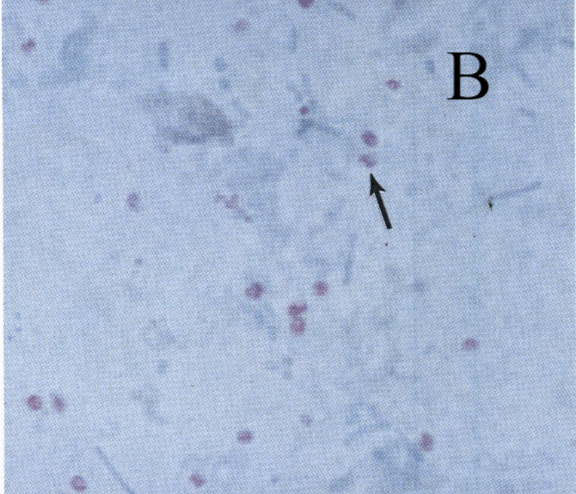
图1 比氏肠微孢子虫孢子的透射电子显微图(A)[2]和孢子染色图(×1800)(B)[2]
1.1.3生化特征
比氏肠微孢子虫高度依赖宿主代谢,缺乏线粒体和完整的能量合成途径,通过直接摄取宿主ATP维持生存,同时它还缺乏典型抗氧化酶和部分代谢通路,对苯并咪唑类药物敏感,但对磺胺类耐药。在60°C加热30分钟或煮沸(100°C)5分钟可有效灭活其孢子,同时使用5%过氧乙酸、6%过氧化氢、氨水(10%)或福尔马林等试剂也可有效灭活其孢子。
1.2分布、传播与致病性
1.2.1分布与传播
比氏肠微孢子虫呈全球分布,是一种遗传多样化的人畜共患寄生虫,宿主范围很广,包括人类、牲畜和野生动物。人类通常通过吞咽寄生虫的传染性孢子感染比氏肠微孢子虫,孢子通过粪便排泄,很容易通过粪口途径在宿主之间传播。此外,孢子还存在于各种来源中,包括被粪便污染的水、土壤和环境表面,以及用处理不当的水灌溉的水果和蔬菜。比氏肠微孢子虫因其通过水传播的能力和广泛的宿主范围而受到广泛关注[3]。
1.2.2致病性
比氏肠微孢子虫病最常见于严重细胞免疫缺陷患者,主要症状是慢性非血性腹泻,无发热,厌食,体重减轻约2公斤/月,有些患者会出现间歇性腹泻,少数患者会排出微孢子虫孢子而不腹泻。大便呈水样或软质,排便次数通常为每天3-7次,很少情况下可达每天20次。
人类比氏肠微孢子虫感染通常限于肠道和胆道上皮。感染开始于小肠的肠道上皮细胞,寄生虫位于顶端细胞质的核上区。组织学表现可从基本正常的绒毛结构到严重的上皮变性。在某些情况下,组织病理学变化包括绒毛萎缩和融合、隐窝延长、杯状细胞减少、显著的上皮内淋巴细胞浸润和肠上皮细胞囊泡形成、肿胀或脱落。此外,在胆管上皮、非实质肝细胞和胰腺导管上皮以及气管、支气管和鼻上皮中也偶尔会发现比氏肠微孢子虫[4]。
1.3检测方法
(1)传统方法:主要形态学检测方法。在光学显微镜下观察到微孢子虫孢子是检测的金标准。此外镜检染色方法也是一种常用方法,包括吉氏染色、亚甲蓝染色、抗酸染色、苏木精-伊红染色和革兰染色等,也有改良三色染色法、改良抗酸染色法等[5]。
(2)免疫学方法:主要是血清抗体检测和血清抗原检测。血清抗体检测方法包括凝集素试验、酶联免疫吸附试验等;血清抗原检测方法包括酶联免疫吸附试验、免疫荧光试验、蛋白质免疫印迹等[5]。
(3)分子生物学方法:巢式PCR、多重PCR、实时荧光定量PCR、环介导等温扩增、CRISPR/Cas12a检测技术等均可用于比氏肠微孢子虫检测。例如基于SSU rRNA基因的内转录间隔区(ITS)的巢氏PCR法,设计引物,配置PCR反应体系,第一轮PCR反应所用模板为样本所提取的DNA产物,第二轮反应所用模板则为第一轮PCR反应产物。按照以下程序:94℃预变性3 min;35个循环包括94℃变性45 s,55℃退火45 s和72℃延伸60 s;最后72℃延伸10 min;反应结束后4℃保温[6]。
表1 比氏肠微孢子虫巢氏PCR引物序列[6]
| 轮次 | 引物名称 | 引物序列5′-3′ | 产物大小(bp) |
| 1 | Z1 | GATGGTCATAGGGATGAAGAGGTT | 410 |
| Z2 | TATGCTTAAGTCCAGGGAG | ||
| 2 | Z3 | AGGGATGAAGAGCTTCGGCTCTG | 392 |
| Z4 | AGTGATCCTGTATTAGGGATATT |
1.4典型案例
2013年3月,在中国上海的饮用水源黄浦江中发现了数千具家猪尸体。于 2013年3月至2014年3月从黄浦江上游采集了178份河水样本。通过PCR检测测序确定了主要是由于猪感染了隐孢子虫和比氏肠微孢子虫,最终导致了黄浦江的病原菌污染。因此,需要进一步的规定和对动物尸体的处理进行严格控制,才能防止未来发生影响人类健康的环境污染[7]。
1.5防治对策
比氏肠微孢子虫传播途径广,首先应尽量切断其传播途径,注意饮食卫生,不饮用生水,避免食用未经充分烹饪的水产品;同时,加强环境卫生管理,防止水源和食物被污染。其次,对于感染者,可根据具体情况选择合适的药物进行治疗,如阿苯达唑或烟曲霉素等。此外,还应加强流行病学监测,尤其是对动物宿主的监测,以及时发现和控制传染源。
参考文献
[1] 刁瑞南, 肖立华, 宋铭忻 等. 毕氏肠微孢子虫基因分型及公共卫生学重要性. 中国预防兽医学报, 2014, 12: 988-991.
[2] Weber, Rainer MD, Bryan et al. Improved Light-Microscopical Detection of Microsporidia Spores in Stool and Duodenal Aspirates. The New England Journal of Medicine, 1992, 326: 161-166.
[3] Ting Z, Kuai Y, Junchen X et al. Enterocytozoon bieneusi in Wild Rats and Shrews from Zhejiang Province, China: Occurrence, Genetic Characterization, and Potential for Zoonotic Transmission. Microorganisms, 2024, 12: 811.
[4] Weber R, Bryan RT, Schwartz DA et al. Human microsporidial infections. Clinical Microbiology Reviews, 1994, 7: 426-461.
[5] 秦源, 刘华, 沈玉娟. HIV/AIDS合并毕氏肠微孢子虫感染的研究进展. 中国寄生虫学与寄生虫病杂志, 2022, 40: 760-766.
[6] 彭国华, 胡主花, 路亮 等. 南昌地区HIV/AIDS患者合并毕氏肠微孢子虫感染现状及基因型分析. 中国艾滋病性病, 2024, 30: 847-851.
[7] Hu Y, Feng YY, Huang CC et al. Occurrence, Source, and Human Infection Potential of Cryptosporidium and Enterocytozoon bieneusi in Drinking Source Water in Shanghai, China, during a Pig Carcass Disposal Incident. Environmental Science and Technology, 2014, 48: 14219-14227.
.png)
