1.犬新孢子虫(Neospora caninum)
物种名:犬新孢子虫
拉丁学名:Neospora caninum
分类学地位:真核生物界Eukaryota;顶复门Apicomplexa;
孢子虫纲Sporozoa;真球虫目Eucoccidiorida;
肉孢子虫科Sarcocystidae;新孢子虫属Neospora
犬新孢子虫(Neospora caninum)是一种致死性胞内寄生原虫,最早是由Bjerkas于1984年在患脑膜炎和肌炎的幼犬体中发现,并由Dubey于1988年根据其形态特征命名。新孢子虫可感染犬、牛等多种动物,寄生于宿主体内可导致孕畜流产或产死胎以及新生幼畜运动神经障碍和神经系统疾病等,给养殖业带来巨大损失。
1.1生物学特性
1.1.1生活史
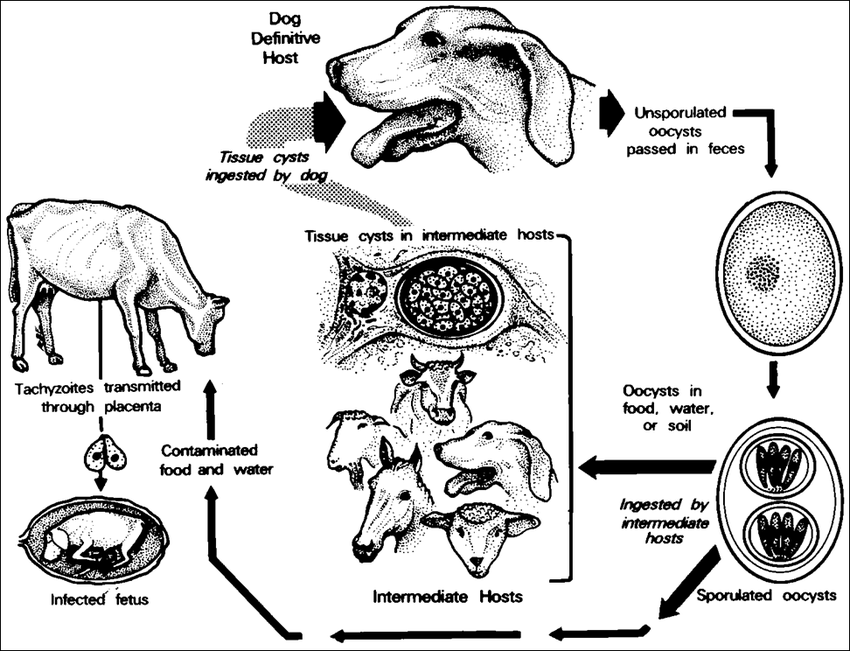
新孢子虫的生活史中,已知有三个传染阶段:中间宿主体内组织包囊中的速殖子和缓殖子、终末宿主排出的卵囊。
犬新孢子虫的终末宿主是犬和一些犬科动物。犬新孢子虫卵囊需要在宿主体内发育到一定阶段才能随着宿主粪便排出体外。当卵囊刚被终末宿主排出后并不具有感染能力,新排出的卵囊需要在外界适宜的条件下进行孢子化,发育为孢子化卵囊,才具有感染能力。
犬新孢子虫的中间宿主范围广,包括牛、羊、兔、鸡、鸽、棕熊、土狼、赤狐、狼、猞猁、野猫啮齿动物在内的哺乳动物和鸟类均可感染犬新孢子虫。当犬新孢子虫的中间宿主在进食或饮水时,摄入了犬新孢子虫孢子化卵囊,即可能被感染。已孢子化的卵囊在犬新孢子虫的中间宿主肠道中完成脱囊,释放出子孢子并迅速发育为速殖子。速殖子入侵中间宿主的多种有核细胞,并在宿主细胞质中形成寄生虫空泡,进行无性增殖,产生大量的速殖子,最终导致宿主细胞破裂,纳虫空泡内的速殖子被释放并再次入侵邻近细胞或通过血液循环扩散到全身入侵其他细胞。速殖子大量繁殖可能引发严重的急性新孢子虫病。
当宿主动物的免疫力正常时,机体发生免疫反应清除虫体,机体内的速殖子转化为缓殖子,位于大脑和肌肉等多个组织中的组织包囊中,此时动物处于慢性感染状态。
当宿主动物免疫力下降或处于妊娠等特殊生理状态时,组织包囊中的缓殖子转化为速殖子并大量增值,宿主动物出现急性感染症状。
在终末宿主犬科动物摄入犬新孢子虫组织包囊后,速殖子在终末宿主的肠道内完成脱囊,脱囊后进入终末宿主的肠道上皮细胞,并在肠道上皮细胞进行裂殖生殖,产生裂殖子。随着分裂的进行,有一部分裂殖子发育成为大配子体和小配子体。大配子体和小配子体结合进行有性生殖产生合子。合子在终末宿主体内继续发育为犬新孢子虫卵囊。卵囊成熟后,随终末宿主的粪便排到环境中,在适合的条件下完成孢子化过程,成为有感染能力的卵囊,并完成整个生活史[1]。
1.1.2形态学特征
犬新孢子虫在生长发育过程中典型的形态有速殖子(Tachyzoites)、组织包囊(Tissue Cysts)和卵囊(Oocysts)。速殖子和组织包囊是存在于中间宿主体内的阶段,且均发生于细胞内。速殖子为卵圆形、月牙形或球形,大小约为6×2 µm。组织包囊通常呈圆形或椭圆形,长度可达107 µm,主要存在于宿主动物的中枢神经系统。组织包囊囊壁厚度可达4 µm,其内所含的缓殖子(Bradyzoites)大小为(7-8)×2 µm,包囊内常有管泡状结构,主要寄生于脊髓和大脑中。神经外组织,尤其是肌肉组织也可能含有组织包囊[3, 4]。卵囊由终末宿主排出,大小为(10.6-12.4)×(10.6-12.0) µm[2]。
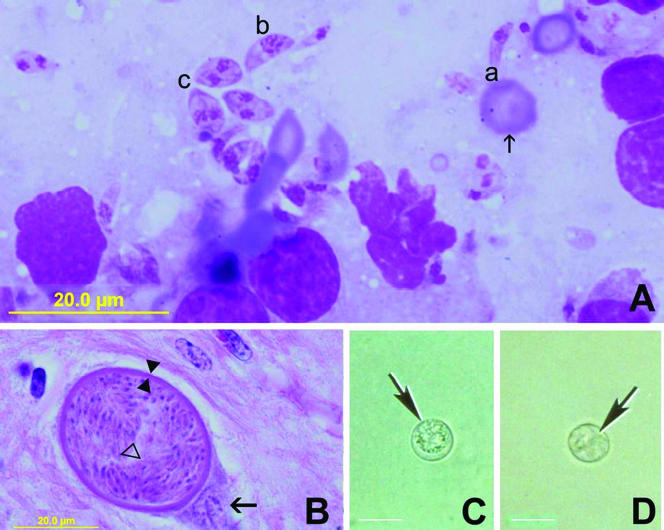
图2 犬新孢子虫形态结构[5]
A:速殖子(Giemsa染色),B:先天性感染小牛脊髓神经元内组织包囊的组织学切片(苏木精和伊红染色),厚厚的囊壁(对立的箭头)包围着细长的缓殖子(空心三角形)
C:未孢子的卵囊,D:孢子状卵囊
1.1.3生化特征
犬新孢子虫卵囊的活力仅在100℃环境中持续1分钟或室温下被10%的次氯酸钠处理1小时作用下会被完全破坏,而在-20℃至4℃下持续6小时、60℃持续1分钟、70%乙醇、甲醛、碘伏及氨水等均无法有效灭活,其强抗性源于卵囊壁的致密蛋白质基质对化学渗透的天然屏障作用[5]。
1.2分布、传播与致病性
1.2.1分布与传播
新孢子虫病呈世界性分布,其传播方式分为水平传播和垂直传播两种。
水平传播是指动物摄入速殖子或携带组织包囊的组织或被孢子卵囊污染的食物或饮水而感染犬新孢子虫。
垂直传播是妊娠期间速殖子从受感染的母体经过胎盘传播到胎儿[1]。
1.2.2致病性
犬新孢子虫病的发病机理取决于速殖子在细胞内穿梭和繁殖的能力与宿主阻止其繁殖的能力之间的平衡。与其他种属不同的地方在于:犬新孢子虫可以识别一个或者多个宿主细胞表面的受体,这些受体主要负责细胞入侵的过程。
细胞入侵是犬新孢子虫病发病机理中极为关键的一个因素,该过程有两个不同的步骤:黏附于宿主细胞表面和侵入细胞内。黏附于宿主细胞表面是初始步骤,是由低亲和力的接触所介导的,从而诱导微囊分泌了微丝蛋白。犬新孢子虫的外膜通过上述方式与宿主细胞的质膜发生特异性的接触,并进行重新定位,随后以向前推进的方式进入细胞质,使其被寄生虫空泡(PV)所包裹。细胞入侵这个过程所需要的能量仅来源于犬新孢子虫代谢所产生的能量。目前,从犬新孢子虫中发现了十多种分泌蛋白和两种主要的表面抗原,它们与细胞入侵和PV的形成有关。
犬新孢子虫进入宿主体内后,立即诱导宿主改变代谢方式,从而为其生存提供良好的条件,逃避宿主的免疫反应。感染犬新孢子虫后,宿主的免疫反应之一是CD8+T细胞反应,IFNγ的产生是CD8+T细胞在犬新孢子虫病过程中发挥保护作用的一个重要因素[6]。
感染犬新孢子虫的宿主动物在临床上主要表现为繁殖障碍,如出现流产、死胎、畸形胎、胎儿发育不良等症状,特别是肉牛或奶牛。终末宿主犬科类动物在感染犬新孢子虫后也会出现严重的临床现象,多见于新生幼犬,且以神经症状和后肢麻痹为主,严重者还将伴随着皮肤病、肌肉炎等症状,症状越严重越明显的地方,其寄生在该部位的犬新孢子虫越多。然而,与受其危害最为严重的牛和表现出明显临床症状的犬科动物相比,禽类及多数野生动物却没有明显的临床症状[7]。
1.3检测方法
(1)病原学检查:采用染色镜检的方法,一般采用动物的脑、心和肝等制作组织切片,镜检观察有无犬新孢子虫的速殖子或组织包囊。病原学诊断是最准确可靠的一种方法,但比较耗时也较难将其与弓形虫进行鉴别诊断,还需借助其他方法综合诊断[8]。
(2)分子生物学方法:Loschenberger等人提出一种间接原位PCR法检测犬新孢子虫,结合PCR高灵敏度与免疫组化原位显示优势,通过PRINS反应掺入DIG-11-dUTP,用抗DIG-FITC抗体可视化产物。针对Nc5区域设计引物,PCR经35个循环,PRINS为单循环,在感染细胞和组织中获清晰信号,与弓形虫无交叉反应[9]。
表1 犬新孢子虫in situ PCR检测的引物序列
| 引物名称 | 序列 |
| 外引物1(Np6) | 5′-ccccaaaccccaaaccccGTGCGTTCCAATCCTGTAA-3′ |
| 外引物2(Np21) | 5′-ggggtttggggtttggggCAGTCAACCTACGTCTTCT-3′ |
| 内引物1 | 5′-CGAGGGAGTTGGTAGCGGTGAGA-3′ |
| 内引物2 | 5′-CCTCGTCCGCTTGCTCCCTATG-3′ |
1.4典型案例
J.P.Dubeya等人对多种海洋哺乳动物进行血清学检测,发现海獭、海象、海豚等动物体内存在犬新孢子虫抗体。这表明这些海洋哺乳动物曾暴露于犬新孢子虫。海洋哺乳动物生活在海洋环境中,水是它们生存的重要介质,其感染犬新孢子虫很可能与水有关[10]。
1.5防治对策
应保持严格的生物安全以防止疾病进入。此外,应尽量减少水平传播的风险因素,禁止犬只进入饲料储存区、喂食槽和水域,在所有产犊和流产后,小心及时地处理胎盘和胎儿,不要给农场狗喂生牛肉,开展监测计划,检查所有流产母体血清,以监测畜群疾病状况等[11]。
参考文献
[1] 陈曦. 犬新孢子虫抗体间接ELISA检测方法的建立及初步应用. 西北农林科技大学, 2023.
[2] Dubey JP. Review of Neospora caninum and neosporosis in animals. Korean J Parasitol, 2003, 41: 1-16.
[3] 陈谊, 缪德年, 李春华. 猪病原感染与感染症. 上海: 上海科学技术出版社, 2022.
[4] Dubey JP, Schares G, Ortega-Mora LM. Epidemiology and control of neosporosis and Neospora caninum. Clin Microbiol Rev, 2007, 20: 323-67.
[5] Neto AFA, Bandini LA, Nishi SM et al. Viability of sporulated oocysts of Neospora caninum after exposure to different physical and chemical treatments. J Parasitol, 2011, 97: 135-139.
[6] 吕秋艳. 湖南省鸡鸭弓形虫和犬新孢子虫感染现状及弓形虫基因型分布研究. 湖南农业大学, 2021.
[7] 刘梦婷. 湖南省益阳地区野鸟弓形虫和犬新孢子虫感染调查及弓形虫基因型研究. 湖南农业大学, 2019.
[8] 郑和良. 湖南省肉牛弓形虫和犬新孢子虫感染现状及弓形虫基因型分布研究. 湖南农业大学, 2021.
[9] Loschenberger K, Szolgyenyi W, Pesch ke R et al. Detection of the protozoan Neospora caninum using in situ polymerase chain re-action. Biotech Histochem, 2004, 79: 101-105.
[10] Dubey JP, Zarnke R, Thomas NJ et al. Toxoplasma gondii, Neospora caninum, Sarcocystis neurona, and Sarcocystis canis – like infections in marine mammals. Veterinary Parasitology, 2003, 116: 275-296.
[11] Farm Health Online. Neospora caninum in Cattle. Farm Health Online-Animal Health and Welfare Knowledge Hub, 2018.
.png)
