1.肝片吸虫(Fasciola hepatica)
物种名:肝片吸虫
拉丁学名:Fasciola hepatica
分类学地位:动物界Animalia;扁形动物门Platyhelminthes;
吸虫纲Trematoda;复殖目Digenea;片形科Fasciolidae;
片形属Fasciola
肝片吸虫(Fasciola hepatica)又称肝蛭,是一种人兽共患寄生虫,是目前全世界分布最广泛的吸虫之一,其引发的疾病称为肝片吸虫病。可通过食用被污染的水生植物或饮用含囊蚴的生水等方式,造成人在内的多种哺乳动物感染,不仅严重危害人类健康,还影响畜牧养殖业的发展,造成巨大的经济损失。
1.1生物学特性
1.1.1生活史
肝片吸虫在生长发育过程中依赖椎实螺作为中间宿主,将哺乳动物作为终末宿主。肝片吸虫的成虫主要寄生于终末宿主的肝胆管中。成虫排出的虫卵随胆汁进入十二指肠,进而随着粪便排出体外。虫卵一旦排入水中,便在水中发育为毛蚴。毛蚴遇到中间宿主椎实螺时,迅速钻入螺的体内,在螺的体内经历胞蚴、雷蚴和尾蚴三个发育阶段,完成这三个阶段的发育需要4-7周时间[1, 2]。随后尾蚴逸出螺体,附着于水草上,脱去尾巴形成囊蚴。终末宿主通过采食水草食入具有感染性的囊蚴而引发感染。囊蚴在十二指肠脱囊并发育成童虫,一部分童虫穿过肠壁,在腹腔内移行,经肝包膜进入肝脏。另一部分童虫钻入肠黏膜,经肠系膜静脉进入肝脏发育为幼虫。幼虫继续在终末宿主的肝实质中迁移4-6周[3],以血液和肝细胞为食,然后进入胆管,在胆管内发育为成虫(图1)。据调查,成虫在宿主体内最长存活期:绵羊为11年,牛为9-12个月,人为12年。肝片吸虫染色体核型有3个型:二倍体、三倍体和二、三倍体混合型:染色体数n=10,二倍体是n=20,三倍体是n=30,前者为有性生殖型,后者为孤雌生殖型。我国发现的是二倍体型和三倍体型[4]。
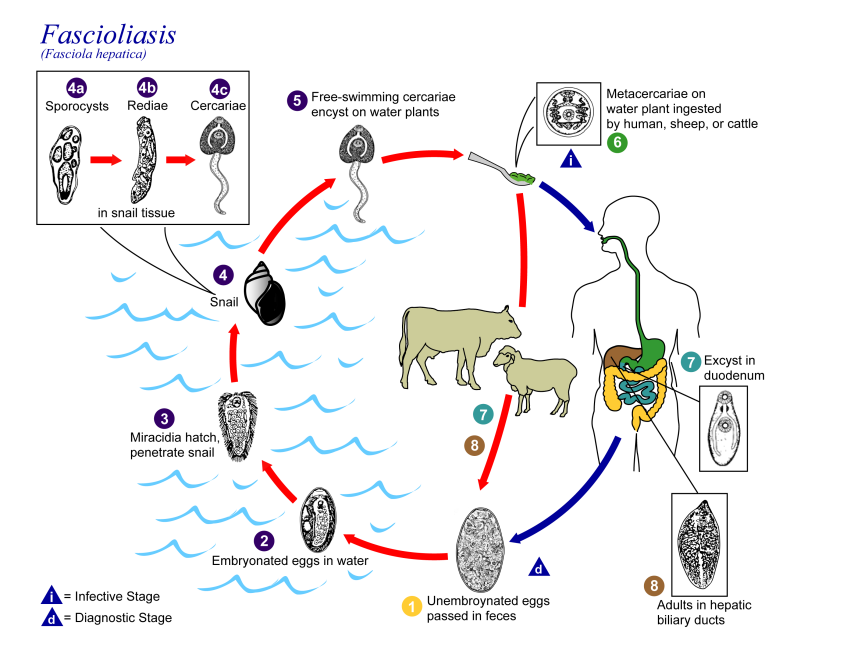
图1 肝片吸虫生活史[5]
1.1.2形态学特征
肝片吸虫成虫外观呈叶片状,自肝胆管取出时呈棕红色,长20-35 mm,宽5-13 mm。虫体前端有一个三角形锥状突,口吸盘直径约为1 mm,位于锥状突的前端。锥状突后,虫体左右展开形成“肩”部。“肩”部以后逐渐变窄。腹吸盘较口吸盘稍大,位于其稍后方。生殖孔位于口、腹吸盘之间。消化系统为不完全消化系统,由口吸盘底部的口孔开始,下接咽和食道及两条具有盲端的肠管,肠管有许多分枝,无肛门。雌雄同体,雄性生殖器官包括两个多分枝的睾丸,前后排列于虫体的中后部,每个睾丸各有一条输出管,两条输出管上行汇合成一条输精管,进入雄茎囊,囊内有贮精管和射精管,其末端为雄茎,通过生殖孔伸出体外,在贮精囊和雄茎之间有前列腺。雌性生殖器官有一个鹿角状的卵巢,位于腹吸盘后的右侧。输卵管与卵模相通,卵模位于睾丸前的体中央,卵模周围有梅氏腺。曲折重叠的子宫位于卵模和腹吸盘之间,内充满虫卵,一端与卵模相通,另一端通向生殖孔。卵黄腺由许多褐色颗粒组成,分布于体两侧,与肠管重叠。左方两侧的卵黄腺通过卵黄腺管横向中央,汇合成一个卵黄囊与卵模相通。无受精囊。体后端中央处有纵行的排泄管(图2A)。
虫卵长133-157 μm,宽74-91 μm,呈长卵圆形,黄色或黄褐色,前端较窄,后端较钝。卵盖不明显,卵壳薄而光滑,半透明,分两层。卵内充满卵黄细胞和一个胚细胞[6](图2B)。

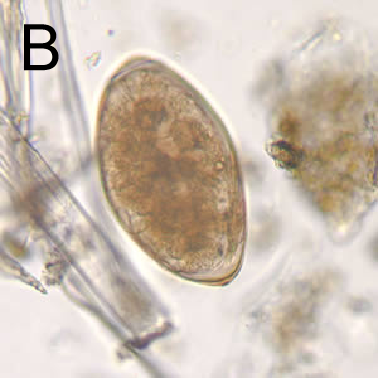
图2 肝片吸虫形态结构
A:成虫,B:虫卵[7]
1.1.3生化特征
肝片吸虫虫卵对高温和干燥较敏感。40-50℃时几分钟内死亡,在完全干燥的环境中迅速死亡。然而,虫卵在潮湿无光照的粪堆中可存活8个月以上。虫卵对低温的抵抗力较强,在2-4℃的水里17个月仍有60%以上的孵化率,但结冰后很快死亡,因此虫卵在结冰的冬季是不能越冬的[8]。
1.2分布、传播与致病性
1.2.1分布与传播
肝片吸虫病在全球及我国广泛流行,尤其多发于低洼地区、稻田和江河流域等适宜中间宿主(20余种椎实螺)孳生的环境。其终末宿主范围广泛,包括牛、羊、猪、马、鹿等数十种哺乳动物,犬、猫也有感染。传播途径包括食用被囊蚴污染的水生植物、饮用生水、生食感染动物内脏[4]。夏秋为感染高发期,幼虫致病多见于秋末冬初,成虫致病则集中于冬末春季,多雨温暖季节易暴发流行[8]。
1.2.2致病性
肝片吸虫病潜伏期的长短与食入囊蚴的数量和宿主的免疫状况有关。根据患者的临床表现可将肝片吸虫病分为急性期、潜隐期和慢性期3个阶段。少数感染者可不出现临床症状成为带虫者。
急性期(又称侵袭期)为童虫在体内移行阶段,通常发生在感染后2-12周。主要表现为突发高热、腹痛,常伴有腹胀、呕吐、腹泻或便秘等消化道症状,肝脾大、腹水、贫血等。急性期持续2-4个月后进入潜隐期(又称童虫胆管寄生期),此时童虫进入胆管寄生,但尚未发育成熟。患者的急性期症状减退或消失,在数月或数年内无明显不适,或有胃肠道轻度不适。此期病变正逐渐向慢性期过渡。慢性期(又称成虫阻塞期)为成虫长期寄生于肝内胆管,引起胆管炎、胆囊炎和胆管上皮增生等为主要病变基础的一系列临床表现。主要表现为乏力、右上腹疼痛或胆绞痛、恶心、厌食脂肪食物、贫血、黄疸、肝大并有轻微触痛等。童虫在体内移行,可直接侵犯或随血液到达肝脏以外的其他组织器官,引起异位损害(又称肝外片形吸虫病)。临床较常见于肺、支气管、胃、胰、腹膜、脑、眼、膀胱等部位,常在术后检获虫体而被确诊[9]。
其致病机制及病理是肝片吸虫囊蚴经口感染后,在消化液和胆汁的作用下后尾蚴脱落而出,童虫穿过肠壁,经腹腔侵入肝突质,数周后直接侵人肝内胆管,或淋巴、血液循环进入胆管定居,发育为成虫。童虫移行和成虫寄生都可对机体产生机械损伤和化学毒害作用,引起肝胆系统的病变。病变的轻重程度与感染的虫数、移行途径、寄生部位及机体的免疫状况等因素有关。
童虫致病是由于童虫在体内窜扰移行可引起局部组织和腹膜的损伤和炎症,随着童虫的长大,损害作用逐渐明显而广泛,严重者可致纤维蛋白性腹膜炎。侵入肝脏的童虫以肝细胞为食,可引起肝脏的广泛损伤和炎症,一般表现为损伤性肝炎,也可表现为炎症、坏死、纤维化等渐进性病理改变,甚至出现肝萎缩,若损伤血管可致肝突质梗死和出血性损伤。童虫移行造成的肝损伤中充满肝细胞残片、嗜中性粒细胞、红细胞、淋巴细胞、嗜酸性粒细胞和巨噬细胞,周围有退变的肝细胞、巨噬细胞、嗜酸性粒细胞和单核细胞浸润。在较久的损伤处逐渐由巨噬细胞和成纤维细胞所取代。在这些肉芽组织中有胆小管增生。此外,肝脏中尚可有未达到胆管的未成熟虫体被包囊在纤维囊中。胆管上皮增生现象在虫体达到胆管前就已出现。Isseroff等研究表明,肝片吸虫可产生大量脯氨酸,感染后25天宿主胆汁中脯氨酸浓度增高4倍。此时童虫尚未到达胆管。这说明胆管上皮细胞增生与脯氨酸在胆汁中浓度有关。
成虫致病是成虫寄生肝内胆管,通过机械刺激和毒素过敏作用,引起胆管炎、胆囊炎、慢性肝炎和贫血等。病理变化以慢性增生性改变为主,表现为胆管上皮增生、管壁增厚等。据测定,胆管中有肝片吸虫成虫寄生时,胆汁中脯氨酸浓度可增高万倍以上。脯氨酸在胆汁中积聚是引起胆管上皮细胞增生的重要原因。
轻度感染时,胆管呈局限性扩大,重感染者则胆管的所有分支均可增厚。从肝表面可见白色条索状结构分布于肝组织中,有时增厚和钙化的胆管可突出于肝表面。再加上结缔组织的增生,使肝表面变得粗糙不平。这种病理变化以肝敷面尤为明显。胆管扩张多因虫体和胆汁阻塞所致[4]。
1.3检测方法
(1)病原学检查:在粪便中镜检出黄色的椭圆形肝片吸虫的虫卵即可确诊肝片吸虫病,常见粪检法包括直接涂片法、自然沉淀法和Kato-Katz法。但该方法需虫体发育至成虫期才能检测,效率低,易造成假阴性和环境污染,感染率低、早期或异位寄生时不适用[10]。
(2)分子生物学方法:以肝片吸虫保守的核糖体DNA ITS-2区域为基础,设计了TaqMan探针引物,建立了实时荧光定量PCR检测肝片吸虫的方法。所构建方法检测质粒模板DNA的动态范围为1×100-1×106拷贝,敏感度可检测到1拷贝质粒DNA,而且与多种吸虫无交叉反应,特异性良好[11]。
表1 肝片吸虫RT-qPCR引物与探针序列
| 引物名称 | 序列 |
| FasITS-F | 5′-ACCCTTGTCTTGGCAGAAAGC-3′ |
| FasITS-R | 5′-CAAACACACTGACAACTGAGTACC-3′ |
| FasITS-Q | 5′-FAM-ACCCGATTATTAAACCACGATTCCGCCACT-ECLIPSE-3′ |
1.4典型案例
据世界卫生组织调查发现:人类食用含有成囊生物的水生植物的或饮用受污染的水后感染肝片吸虫,仅在1970-1990年期间,在42个国家的2594人被感染[12]。在伊朗沿海城市曾出现过大面积的肝片吸虫感染,约有15000人被感染。原因是在8-11月份,稻田灌溉引用的水源传播的疾病。在东安纳托利亚家族爆发的肝片吸虫病是由于食用了水田芥这种植物,以它作为传播媒介引发大范围的感染[13]。
1.5防治对策
本病预防主要是发现病者或家畜应及时隔离治疗,从根本上阻断传染源。其次是结合水利消灭中间宿主或饲养水禽灭螺。在流行区要求每年2次应用复合药物对人、畜驱虫:粪便集中管理,经生物热处理灭卵后再使用,防止虫卵入水。平时注意不在低洼、潮湿的地区放牧,要经常消毒处理,保持水源、饮水清洁卫生[4]。若感染肝片吸虫,临床治疗主要选用硫双二氯酚,也可使用吡喹酮、阿苯达唑、三氯苯达唑等其他药物[9]。
参考文献
[1] Rathinasamy V, Hosking C, Tran L et al. Development of a multiplex quantitative PCR assay for detection and quantification of DNA from Fasciola hepatica and the intermediate snail host, Austropeplea tomentosa, in water samples. Vet Parasitol, 2018, 259: 17-24.
[2] Wang T, Mitchell P D. Liver Fluke Infection Throughout Human Evolution.Gastro Hep Advances, 2022, 1: 500-507.
[3] Young N D, Hall R S, Jex A R et al. Elucidating the transcriptome of Fasciola hepatica-a key to fundamental and biotechnological discoveries for a neglected parasite. Biotechnol Adv, 2010, 28: 222-231.
[4] 陈谊, 缪德年, 李春华. 猪病原感染与感染症. 上海: 上海科学技术出版社, 2022.
[5] https://phil.cdc.gov/Details.aspx?pid=3392.
[6] 王春璈. 奶牛疾病防治学 铂金视频版. 北京: 机械工业出版社, 2023.
[7] https://www.cdc.gov/dpdx/fascioliasis/index.html.
[8] 谢凤云, 张钦凯, 王百川 等. 肝片吸虫的特性及肝片吸虫病的预防与治疗. 畜牧与饲料科学, 2014, 35: 72-74.
[9] 杨维平. 人体片形吸虫病的流行与防治. 医学综述, 2005, 11: 1007-1009.
[10] 艾靖凯, 简莹娜, 张学勇. 肝片吸虫实验室检测技术研究进展. 畜牧兽医杂志, 2025, 44: 103-107.
[11] 王彩霞, 林祥梅, 吴绍强 等. 牛羊肝片吸虫病实时荧光PCR检测方法的建立. 检验检疫学刊, 2017, 27: 1-4.
[12] SABA R, KORKMAZ M, INAN D et al. Human fascioliasis. Clin Microbiol Infect, 2004, 10: 385-387.
[13] ASHRAFI K,MAS -COMA S. Fasciola gigantica transmission inthe zoonotic fascioliasis endemic lowlands of Guilan, Iran:Experi-mental assessment. Vet Parasitol, 2014, 205: 96-106.
.png)
