1.人副肠孤病毒(Human parechovirus)
物种名:人副肠孤病毒
拉丁学名:Human parechovirus
分类学地位:正核糖病毒界Orthornavirae;小核糖病毒门Pisuviricota;
小南嵌套病毒纲Pisoniviricetes;微小核糖病毒目Picornavirales;
微小核糖病毒科Picornaviridae;副肠孤病毒属Parechovirus
人副肠孤病毒(Human parechovirus, HPeV)于1956年首次被分离出来,直到1997年才被归入单独的副肠孤病毒属,目前分为19种基因型,即HPeV1-19。该病毒经常导致幼儿患胃肠道或呼吸系统疾病,主要通过粪口途径传播。
1.1生物学特性
1.1.1培养特征
研究表明,不同HPeV基因型的培养结果各不相同。HPeV1可以在各种细胞系上培养,如BSC-1、Caco2、RD-18S、Vero、LLCMK2、RD99、HT29、tMK和A549,而其他较新的HPeV仅在有限数量的细胞系上诱导低细胞病变效应(CPE)[1]。
1.1.2形态学特征
人副肠孤病毒颗粒呈球形,直径大约是28 nm,无包膜,全长大约7300个核苷酸,为单股正链RNA病毒。HPeV衣壳由60个原聚体结构组成,衣壳蛋白呈二十面体立体对称。HPeV基因组分为四个不同的区域:一个长开放阅读框(ORF),一个5’非翻译区(5′-UTR),一个3’非翻译区(3′-UTR)和一个polyA尾。ORF由3个区域构成(P1、P2和P3),P1区包括3个衣壳蛋白(VP0、VP3和VP1)、P2区包括3个非结构蛋白(2A、2B和2C)和P3区包括4个非结构蛋白(3A、3B、3C和3D)[2]。
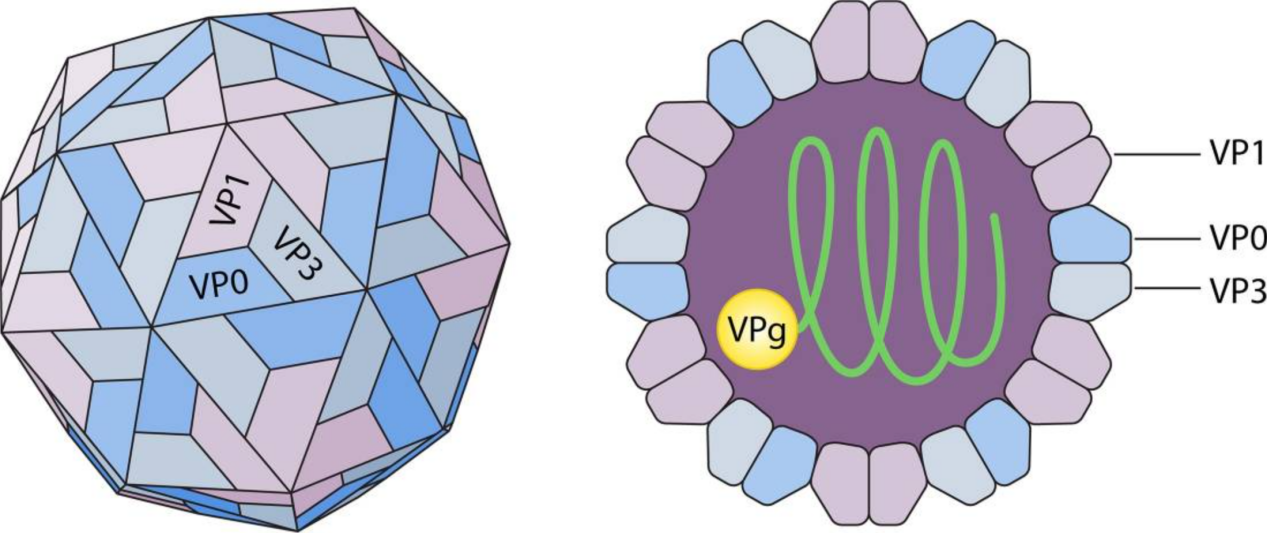
图1 人副肠孤病毒结构示意图[2]
1.1.3生化特征
该病毒的稳定性较强,能耐受10%的氯仿、50℃条件30 min,同时具有抵抗胃酸的作用。研究显示HPeV在粪便较上呼吸道相比,其生存持续时间长,分别约为51天和1-3周[3]。
1.2分布、传播与致病性
1.2.1分布与传播
人副肠孤病毒主要通过粪-口途径和呼吸道传播,其中粪-口传播途径可能涉及被病毒污染的饮用水或娱乐用水(如游泳池),尤其是在卫生条件不足或污水处理不完善的情况下。另外也有与非脊髓灰质炎性急性弛缓性麻痹患者亲密接触而感染该病毒的报道[4]。HPeV可在普通人群中流行,但感染对象主要是儿童。HPeV感染范围广泛,日本、荷兰、巴基斯坦、巴西、中国等多个国家均报道过该病毒的感染,其流行季节因基因型存在差异[5]。
1.2.2致病性
目前已发现19种基因型[2],大多数型别的HPeV均可侵犯消化道,主要引发腹泻病,表现为腹泻、腹胀、呕吐等。其中HPeV1是广泛分布和流行的优势毒株,引发的胃肠道症状轻微。侵犯中枢神经系统的主要是HPeV3。感染对象主要是婴幼儿(尤其是3个月以内),可导致严重的中枢神经系统疾病,如脑炎、脑膜炎、急性弛缓性麻痹等。HPeV感染引发的呼吸道症状无特异性,主要表现为流涕、咳嗽、呼吸急促或暂停及哮喘等。HPeV感染常常伴随其他症状,如发热、易激惹、皮疹、心肌炎及喂养困难等[5]。
HPeV的致病机制尚未完全明确,现有理论主要基于HPeV1和HPeV3的临床表现以及与肠道病毒(EV)的类比研究。其中,HPeV3被认为是引起新生儿及婴幼儿中枢神经系统(CNS)感染的主要亚型,其潜在机制可能涉及以下两方面,其一是神经组织趋向性,HPeV3可能通过血脑屏障侵入CNS,动物模型显示其对脑血管内皮及平滑肌具有直接侵袭能力,导致局部血流灌注异常,进而引发脑损伤。其二关于免疫介导损伤,部分研究提出,HPeV感染可通过激活固有免疫受体(如TLR7/8)触发炎性细胞因子释放,造成继发性组织损伤。然而,临床观察显示,HPeV3相关脑炎患儿的脑脊液常无白细胞增多现象,提示其CNS损伤可能不依赖典型炎症反应,这一矛盾仍需机制性研究解释。值得注意的是,约20%的HPeV3脑炎患儿遗留神经系统后遗症,提示其致病过程可能涉及多因素交互作用,如病毒直接损伤与微循环障碍[6]。
1.3检测方法
(1)传统方法:细胞培养法是鉴定病毒感染的经典方法。目前已知的可作为分离HPeV的细胞系有Vero细胞、BGM细胞、LLC-MK2细胞、MDCK细胞、L20B细胞等。该方法周期较长,不适合快速诊断[5]。
(2)分子生物学法:开发了一种实时荧光定量RT-PCR方法,用于检测人副肠孤病毒(HPeV1-6)及Ljungan病毒(Ljungan virus, LV)。该方法靶向5’非翻译区的保守序列,通过设计简并引物和探针实现广谱检测,灵敏度为1个RNA拷贝/反应,且特异性强,不与肠道病毒或心病毒交叉反应[7]。
表1 人副肠孤病毒实时荧光定量RT-PCR引物序列
| 名称 | 序列(5’→3’) |
| AN345 | GTAACASWWGCCTCTGGGSCCAAAAG |
| AN344 | GGCCCCWGRTCAGATCCAYAGT |
| AN257 | CCTRYGGGTACCTYCWGGGCATCCTTC |
1.4典型案例
泰国清迈2016至2018年环境水监测研究发现,人副肠孤病毒(HPeV)在126份水样中检出率为3.2%,主要分布于废水(Mae Kha Canal)和灌溉水(Suandok Canal)。基因型分析显示,检出的HPeV包括HPeV1、HPeV5和HPeV6,其中HPeV1占50%。时间分布上,病毒在雨季(如12月、10-11月)更易检出,可能与污水溢流相关。并且在检测的13种肠道病毒中,HPeV占比2.2%,低于诺如病毒(36.8%),但高于轮状病毒(0.5%)[8]。
1.5防治对策
加强卫生管理与环境消毒,落实手卫生、呼吸道礼仪,定期用含氯消毒剂等消毒高频接触表面,保障饮用水安全且避免污水污染;构建三级预防监测网络,扩大监测哨点,追踪人副肠孤病毒毒力与传播变化;严格新生儿感染防控,记录病史,隔离患儿并处理污染物;关注秋冬季节及HPeV3隔年流行时的监控,基层医疗机构对相关症状儿童预检分诊,排查患儿接触人群;建立流动监测体系,强化幼儿园、学校等儿童聚集场所监测,及时报告预警;加强宣传教育,普及防控知识,提高预防意识[3]。
参考文献
[1] Westerhuis BM, Jonker SC, Mattao S et al. Growth characteristics of human parechovirus 1 to 6 on different cell lines and cross- neutralization of human parechovirus antibodies: a comparison of the cytopathic effect and real time PCR. Biology and Medicine, 2013, 10: 146.
[2] Olijve L, Jennings L, Walls T. Human Parechovirus: an Increasingly Recognized Cause of Sepsis-Like Illness in Young Infants. Clin Microbiol Rev, 2017, 31: e00047-17.
[3] 叶郁辉, 吴延杰, 张海龙 等. 人副肠孤病毒流行病学研究进展. 心理月刊, 2020, 15: 235-236.
[4] Li L, Victoria J,Kapoor A et al. Genomic characterization of novel human parechovirus type. Emerg Infect Dis, 2009, 15: 288-291.
[5] 罗雷, 朱汝南. 人副肠孤病毒的研究进展. 中国病毒病杂志, 2013, 3: 310-316.
[6] 陆佩, 曹云. 新生儿副肠孤病毒感染. 中华新生儿科杂志, 2017, 32: 394-397.
[7] Nix WA, Maher K, Johansson ES et al. Oberste MS2008.Detection of All Known Parechoviruses by Real-Time PCR. J Clin Microbiol, 2008, 46: 2519-24.
[8] Kumthip K, Khamrin P, Ushijima H et al. 2023. Detection of Six Different Human Enteric Viruses Contaminating Environmental Water in Chiang Mai, Thailand. Microbiol Spectr, 2023, 11: e0351222.
.png)
