1. 札如病毒(sapovirus)
物种名:沙波病毒
拉丁学名:sapovirus
分类学地位: 正核糖病毒界 Orthornavirae;小核糖病毒门 Pisuviricota;
小南嵌套病毒纲 Pisoniviricetes;小RNA病毒目 Picornavirales;
杯状病毒科 Caliciviridae;札如病毒属 sapoviruses
札如病毒(sapovirus, SaV)与诺如病毒同属杯状病毒科,是除轮状病毒外的人类病毒性腹泻的主要病原体[1]。SaV基因组为单正链RNA,长度约7.3~7.7 kb, 有2~3个开放阅读框(ORF1、ORF2和ORF3),ORF1编码非结构蛋白(NS1-6及NS7 RNA依赖的RNA聚合酶)和主要衣壳蛋白(VP1)。SaV临床多表现为腹泻、腹痛、恶心、呕吐等消化道症状。SaV容易在幼托机构、学校等集体单位引起聚集性疫情[2]。近年来随着分子生物学和实验室检测技术在基层的大力推广,SaV感染所致聚集性疫情的报道呈逐年上升趋势。
1.1生物学特性
1.1.1培养特征
目前仅有少数几株猪Sa V成功在原代猪肾细胞或猪肾细胞系(即LLC-PK1)中获得培养,而这些毒株的成功培养依赖于猪肠内容物或胆汁酸的存在[2]。将生长状态良好的Hu Tu-80细胞均匀接种于7.5 cm培养皿中,待细胞长至70%~80%单层后弃去上清,加入100μL制备的病毒稀释液(约2×106个拷贝数),同时分别添加终浓度500μmol/L的GCDCA或1 000μmol/L GCA,每种胆酸盐设3个重复,以不加病毒稀释液的细胞作为阴性对照置于37℃,5%CO2培养箱中过夜培养。GⅠ.1型Hu Sa V感染的Hu Tu-80细胞添加GCDCA或GCA培养7 d后,GⅠ.1型Hu Sa V感染Hu Tu-80细胞并添加GCA后,病毒滴度从感染后1 d的2 log10拷贝/140μL快速增加至3 d的4.1 log10拷贝/140μL,5 d时达病毒增殖平台期(约4.5 log10拷贝/140μL),见图1[3]。
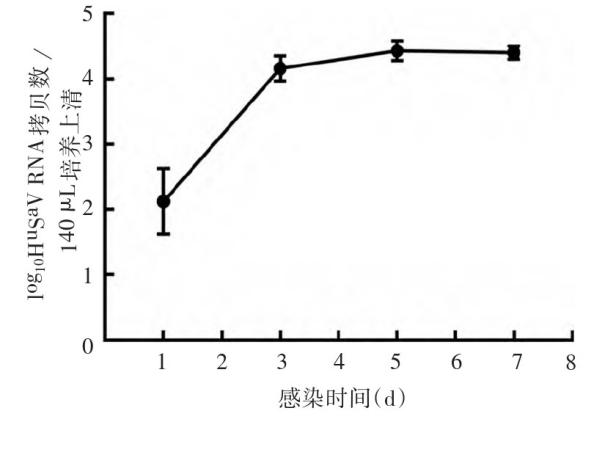
图1 GⅠ.1型Hu Sa V在Hu Tu-80细胞中的生长动力学
1.1.2形态学特征
札如病毒为单股不分节段正链RNA病毒,基因组约为7.1~7.6kb,病毒颗粒直径约为30~38nm,二十面体,无包膜,用电镜可观察到SaV病毒颗粒的六芒星结构,表面有杯状凹陷,部分病毒颗粒的轮廓上可观察到10根纤突。札如病毒可分为5个基因型(GⅠ,GⅡ,GⅢ,GⅣ,GⅤ),其中GⅠ型,GⅡ型,GⅣ型,GⅤ型主要感染人,GⅢ型主要感染猪,GⅠ型、GⅡ型是人类札如病毒的主要基因型。使用从一只狗收集的现场血清,在犬 SaV RNA电子显微镜 (EM) 分析显示,SaV VP1 蛋白能够在直径约为 35 nm(图 2).
a.
c.
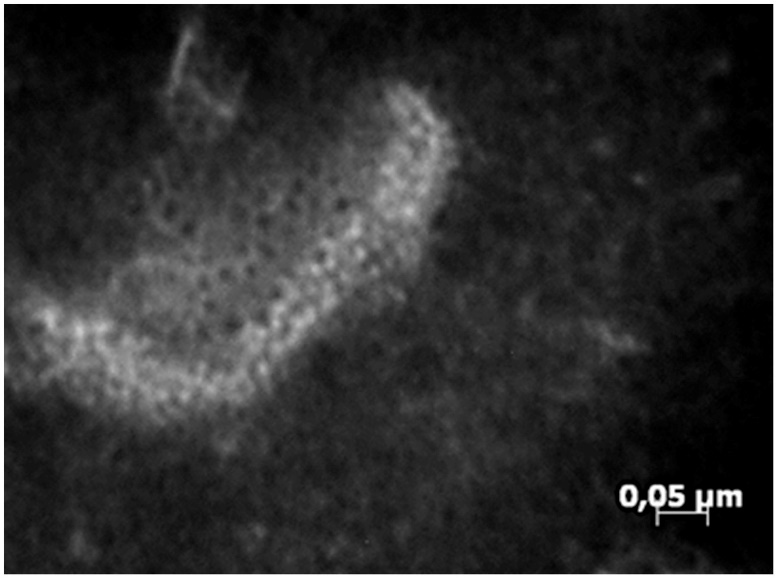
图 2 犬SaV VLP(85,000×)的EM分析
1.1.3生化特征
Hu Sa V可在添加胆酸盐(GCA或GCDCA)的Hu Tu-80细胞中复制及增殖,GCA能够有效促进Hu Sa V对Hu Tu-80细胞的感染及增殖,但GCDCA未如上述文献报道促进Hu Sa V的感染。可能国内GⅠ.1型Hu Sa V与国外毒株对胆酸盐的敏感性存在一定差异细胞上清的PCR产物经1.5%琼脂糖凝胶电泳分析,可见279 bp的特异条带,大小与预期一致,且GCA能有效促进病毒对细胞的感染。见图3。
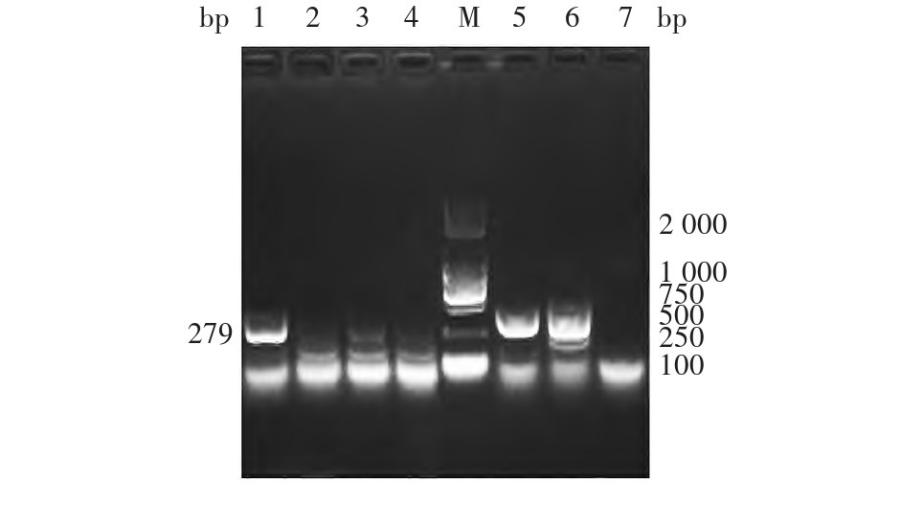
图3 Hu Sa V感染的Hu Tu-80的PCR产物电泳图
1.1.4 分子生物学特征
本实验结果显示,随着病毒感染代次增加,其增殖能力有衰减趋势,分析可能该毒株对Hu Tu-80细胞感染适应性并不十分理想。近年来,实验室对Sa V的诊断及流行检测除电镜观察其形态外,最常用的方法是ELISA和RT-PCR,而Sa V VP1蛋白属于衣壳蛋白,是完整病毒的主要组成部分[3]。
1.2分布、传播与致病性
1.2.1 分布与传播
SaV感染全年均可发生,主要集中在秋冬季。原因可能与以下几点有关:气温相对较低,病毒在环境中存活时间延长。文献报道显示SaV疫情好发于温度较低月份[4]。换季时间儿童易感冒等引起免疫力下降,易被病毒侵袭致病。疫情发生事件均在禁渔期之后,人类对贝类的接触量会增大,研究表明贝类可被SaV污染[5]。,人类接触或食用贝类可能被感染。
1.2.2 致病性
SaV感染者临床表现与诺如病毒相似,常见腹泻、呕吐、腹痛等消化道症状[4]。本研究中,8起疫情临床表现以呕吐、腹泻及腹痛为主,与以往报道一致。但每起疫情均以呕吐表现为主,感染病例出现呕吐的占病例总数的95.76%,腹痛占33.05%,腹泻占13.56%。SaV传播途径复杂,食物传播及人与人传播均可,它的特点是低感染剂量和高水平的病毒排泄,传染性极强[6]。
1.3检测方法
目前,实时荧光定量聚合酶链式反应(Quantitative Real-time PCR,RT-q PCR)是Sa V的常规检测方法,WONGBOOT等[7]开发了一种多重RT-q PCR检测技术,该技术可在检测Sa V的同时检测其他18种腹泻病原体,有助于Sa V合并感染的诊断。VARELA等[8]建立了一种用于检测Sa V的数字PCR(Digital Real-time PCR,RT-d PCR)法。该技术较RT-q PCR具有更高的灵敏度,且对粪便中的聚合酶抑制剂表现出更大的耐受性,具有极好的临床应用前景。
1.4典型案例
监测河流水和污水中的 SaV,对豪登省三条河流的水进行了两年的监测,在 18% (3/17)、45% (29/64) 和 89% (16/18) 的标本中检测到 SaV,在肯尼亚,在 34% (10/29) 的河水样本和 31% (4/13) 的城市污水处理样本中检测到 SaV表明 SaV 的广泛分布[13]。
1.5防治对策
- 应不断完善水源、贝类Sa V的监测体系。
- 必须重视Sa V的人畜共患可能,对于已经感染SAV病毒的动物,要做好消杀工作。避免聚集性感染[9- 12]。
参考文献
- MAGWALIVHA M,KABUE J P,TRAORE A N,et al.Prevalence of human sapovirus in low and middle income countries[J].Adv Virol,2018,2018:5986549.
- OKA T,MORI K,IRITANI N,et al.Human sapovirus classification based on complete capsid nucleotide sequences[J].Arch Virol,2012,157(2):349-352.
- 杜文静,刘丹,丛鑫等. GⅠ.1型人札如病毒的体外培养及其衣壳蛋白VP1多克隆抗体的制备 [J]. 中国生物制品学杂志, 2023, 36 (05): 574-579. DOI:10.13200/j.cnki.cjb.003895.
- 于悦,郭新慧,严寒秋,等.札如病毒急性胃肠炎暴发特征系统综述[J].中华流行病学杂志,2019,40(1):93-98.YU Y,GUO X H,YAN H Q,et al.Systematic review on the characteristics of acute gastroenteritis outbreaks caused by sapovirus[J].Chin J Epidemiol,2019,40(1):93-98.(in Chinese)
- 王虹玲,张辉,吴昺.舟山市海产贝类和食源性腹泻病例中肠道腹泻病毒监测[J].中国食品卫生杂志,2018,30(4):415-420.WANG H L,ZHANG H,WU B.Monitoring analysis of diarrhea virus from marine seashellsand foodborne diarrhea cases in Zhoushan City[J].Chin J Food Hyg,2018,30(4):415-420.(in Chinese)
- BECKER-DREPS S,BUCARDO F,VINJÉ J.Sapovirus:an important cause of acute gastroenteritis in children[J].Lancet Child Adolesc Health,2019,3(11):758-759.
- WONGBOOT W,OKADA K,CHANTAROJ S,et al.Simultaneous detection and quantification of 19 diarrhea-related pathogens with a quantitative real-time PCR panel assay[J].JMicrobiol Methods,2018,151:76-82.
- VARELA M F,MONTEIRO S,RIVADULLA E,et al.Development of a novel digital RT-PCR method for detection of human sapovirus in different matrices[J].J Virol Methods,2018,254:21-24.
- 郭黎,邵云平,陈春枝等. 北京市海淀区2015—2018年札如病毒聚集性疫情的流行病学特征分析 [J]. 实用预防医学, 2020, 27 (01): 91-93.
- 姚萍,李琼,蒋霞等. 常州市2019—2022年学校札如病毒聚集性疫情的流行病学及病毒基因特征分析 [J]. 中国学校卫生, 2023, 44 (10): 1574-1577. DOI:10.16835/j.cnki.1000-9817.2023.10.030.
- 史蓉婕,杨梅,许玉成等. 对某中学一起因札如病毒感染导致急性胃肠炎疫情的调查 [J]. 医学动物防制, 2023, 39 (10): 998-1002+1007.
- OKA T,STOLTZFUS G T,ZHU C,et al.Attempts to grow human noroviruses,a sapovirus,and a bovine norovirus in vitro[J].Plos One,2018,13(2):e0178157.DOI:10.1371/journal.pone.0178157.
- T.Y. Murray, J. Mans, M.B. Taylor, Human calicivirus diversity in wastewater in South Africa, Journal of Applied Microbiology, Volume 114, Issue 6, 1 June 2013, Pages 1843–1853
.png)
