1.柯萨奇病毒(Coxsackieviruses)
物种名:柯萨奇病毒
拉丁学名:Coxsackieviruses
分类学地位: 病毒界Viruses;RNA病毒门RNA viruses;
单股正链RNA病毒纲Single-stranded positive-sense RNA virus class;小RNA病毒目Picornavirales;
小RNA病毒科Picornaviridae;肠道病毒属Enterovirus
柯萨奇病毒(Coxsackievirus)是一种肠病毒(enterovirus),分为A和B两类,是一类常见的经呼吸道和消化道感染人体的病毒,感染后人会出现发热、打喷嚏、咳嗽等感冒症状。柯萨奇病毒为1948年Gillbert Dalldorf博士和他的同事在寻找治愈脊髓灰质炎疾病的过程中在粪便样品中首次获得,因在纽约柯萨奇小镇发现而得名。同其他类型肠道病毒相同,柯萨奇病毒可通过粪口途径和口口途径传播。其中,接触感染者粪便污染的水、食物及土壤可以导致粪口途径传播。一般情况下,婴幼儿大多隐性感染;而5岁以下,尤其是3岁以下儿童,排毒时间可长达一个月。病毒感染人体后,可引起上呼吸道感染、急性心肌炎等疾病,对婴幼儿的健康造成严重威胁
1.1生物学特性
1.1.1培养特征
通过对接种病毒后的细胞进行观察,CVB1、2、3型均能在KMB17细胞上进行培养并使细胞产生CPE。CVB1、2、3型感染细胞后造成细胞变圆皱缩脱落(图1)。
CBV5-MPP以5倍的倍数感染MIN-6细胞平行孔。每隔一段时间采集标本,用免疫荧光法对病毒抗原进行染色,跟踪病毒复制的进展。如图2所示,在感染后1天和2天染色的培养物中仅见少量感染细胞。然而,感染3天后,可以看到几个受感染的细胞,这表明已经发生了对病毒复制的适应。再孵育24小时后,MIN-6细胞完全裂解(未示出),并在第6天收获MIN-6细胞适应病毒株[1]。

图 1 CVB1-3型在KMB17细胞上培养引起的细胞病变(40×)(A)CVB1在KMB17细胞上引起的CPE(B)CVB2在KMB17细胞上引起的CPE(C)CVB3在KMB17细胞上引起的CPE(D)KMB17细胞正常对照[2]
1.1.2形态学特征
采用KMB17株对CVB1、2、3型进行适应性培养,探索应用KMB17细胞培养CVB1-3型病毒的相关参数,取3种血清型CVB病毒收获液于电镜下观察,均可见到典型的病毒颗粒(图2)。

图 2 电镜观察病毒颗粒(A) CVB1型(B)CVB2型(C)CVB3型 (20 000×)[1]
1.1.3生化特征
采用微量细胞病变法测定不同MOI条件下3种血清型病毒在KMB17细胞上培养后达到80%CPE时获得的收获液滴度,结果如图3。一定范围内3种血清型CVB在细胞上培养后收获液的滴度均随MOI值的上升而增加,其中CVB1收获液滴度在MOI值达到0.25时出现平台期,CVB2收获液滴度在MOI值达到0.2时出现平台期,CVB3收获液滴度在MOI值达到0.3时出现平台期。
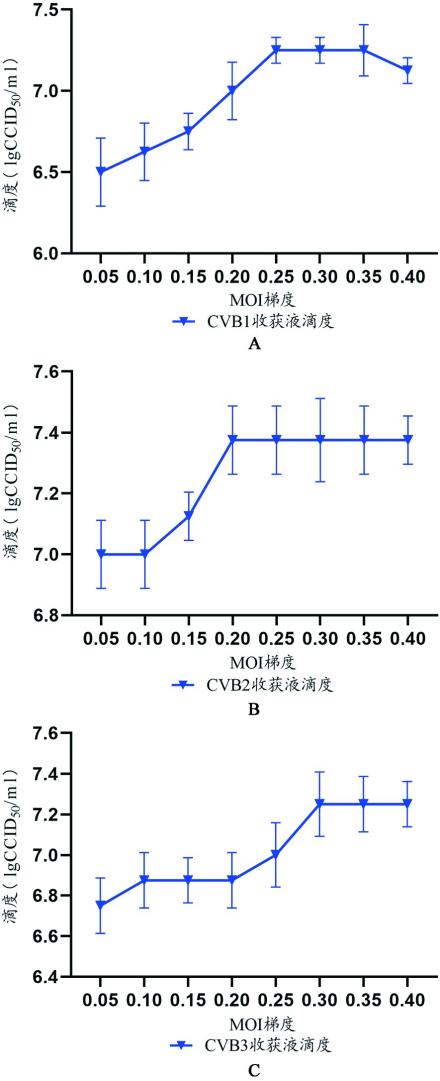
图3不同MOI条件下KMB17细胞收获液的CVB 1、2、3型病毒滴度(A)KMB17细胞培养CVB1型收获液滴度(B)KMB17细胞培养CVB2型收获液滴度(C)KMB17细胞培养CVB3型收获液滴度
1.1.4 分子生物学特征
CV-A6 是小核糖核酸病毒肠道病毒属中肠道病毒 A 组的成员,病毒颗粒呈球形,无包膜,正20 面体对称。与其他肠道病毒类似,CV-A6具有单股正链RNA基因组,其长度约7400个核苷酸。基因组含有编码多聚蛋白的单一开放阅读框(open reading frame ,ORF),并且侧翼有5’和3’非翻译区(UTR)。表达的多聚蛋白可进一步水解成P1,P2和P3三个前体蛋白;P1区编码4 种结构蛋白VP1~VP4;P2和P3区编码7种非结构蛋白:2A、2B、2C、3A、3B、3C和3D。
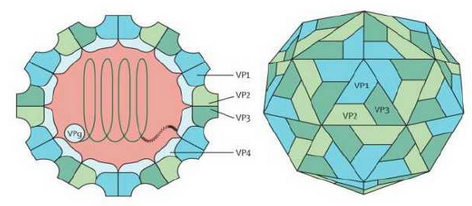
图4 CV-A6的病毒结构[2]
1.2分布、传播与致病性
1.2.1 分布与传播
为了确定长春株病毒与其他已经报道的CV-A6株之间的系统发育关系,从GenBank (http://www.ncbi.nlm.nih.gov/genbank/)检索了各种公开发表的CV-A6序列,其中包括在1949年被分离的原型株Gdula[3]。构建系统进化树,系统发育分析确定了CV-A6的三个主要分支与来自世界各地的CV-A6具有相关性。这一结果表明,中国东北地区出现的HFMD是由于多样性的引入外源的CV-A6株造成的[2]。
1.2.2 致病性
用滴度为105.0~104.0 CCID50 / mL的CC046病毒免疫乳鼠,在感染后第3天开始出现1级症状,随后症状逐渐加重,用这两个滴度免疫的乳鼠分别在第6天和第9天达到5级症状(图5)。用病毒滴度为105.0和104.0 CCID50/mL 的CC046感染的乳鼠,分别在感染后第4天和第5天开始出现死亡现象,分别在感染后的第10天和第11天使100%的乳鼠死亡(图5)。当用103.0和102.0CCID 50/mL这样相对较低滴度的CC046病毒免疫乳鼠时,分别能导致50%和28.6%的死亡率(图5)。
近年来,与EV71或CV-A16无关的HFMD病例也有很多报道,而且由柯萨奇病毒A6型(CV-A6)所引起的手足口病所占的比例越来越高,其引起的临床症状由早期的疱疹性咽峡炎向多部位广泛出疹及伴随脱甲转变[3]。
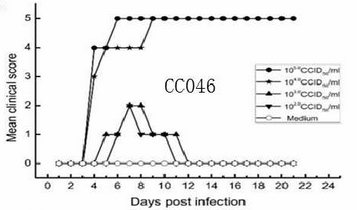
图5 滴度为105.0~104.0 CCID50 / mL的CC046病毒免疫乳鼠
1.3检测方法
1.3.1 动物免疫实验
1.3.1.1 动物模型
使用一日龄无特异性病原体(SPF)ICR新生乳鼠建立病毒感染的动物模型
1.3.1.2 动物免疫
将购买的乳鼠随机分成5组,实验组用3个滴度的四种CV-A6病毒(CC046、CC097、CC098、CC099)分别进行颅内注射,每个滴度的乳鼠8-10只。对照组用DMEM注射。接种21天内,每天监测所有新生乳鼠的临床症状和存活率。使用Reed-Muench方法计算半数致死剂量。
1.3.1.3 病毒载量分析
1.取动物组织和器官2.提取RNA 3.将提取的RNA进行反转录实验得到cDNA,然后用实时定量PCR测量乳鼠各组织器官的病毒载量。
1.3.1.4组织病理学分析
1.取动物组织和器官2.标本制作[4]
1.4典型案例
Marie and Lin (2017)评估了南非 Umhlangane 河中引起水传播的病毒的存在,该河是主要的饮用水集水区以及生活、工业和农业废物的储存库。已确定一些传染性病毒组,包括人类腺病毒、多瘤病毒以及甲型和丙型肝炎病毒,这可能对许多使用河源水用于各种家庭和农业用途的人群构成重大健康风险。此外,据报道,埃及以南 300 公里处的尼罗河河段含有肠道病毒和(柯萨奇病毒),频率为 60%。同样,据报道,南非 Umgeni 河水样中存在病毒样颗粒,表明对人类消费存在潜在的健康风险影响[5]。
1.5防治对策
- 加强水源保护:
(1)确保饮用水源远离污染源,如工业废水、生活污水等。
(2)定期对水源进行监测,确保水质符合安全标准。
- 改善水处理工艺:
(1)采用先进的水处理技术,如过滤、消毒等,有效去除或杀灭水中的病毒和其他病原体。
(2)确保水处理设施的正常运行和维护,防止病毒在处理过程中逃逸。
- 加强水质监测和信息公开:
(1)建立完善的水质监测体系,对饮用水、水源水等进行定期监测。
(2)及时公开水质监测结果,提高公众对水质安全的认知度和参与度。
参考文献
[1] Al-Hello H, Ylipaasto P, Smura T, et al. Amino acids of coxsackie B5 virus are critical for infection of the murine insulinoma cell line, MIN-6[J]. Journal of Medical Virology, 2009, 81(2): 296-304.
[2] 邓自君, 靳玮华, 李艳艳, 等. 应用KMB17细胞培养柯萨奇病毒B族1、2、3型的研究[J]. 中国病原生物学杂志, 2024, 19(1): 10-14.
[3] Puenpa J, Chieochansin T, Linsuwanon P, et al. Hand, Foot and Mouth Disease Caused by Coxsackievirus A6, Thailand, 2012 – Volume 19, Number 4—April 2013 – Emerging Infectious Diseases journal – CDC[J]. [2024].
[4] 刘盼盼. 长春地区由柯萨奇病毒A6型引起的手足口病分子生物学及致病特性的研究[D]. 吉林大学, 2018.
[5] Adelodun B, Ajibade F O, Ighalo J O, 等. Assessment of socioeconomic inequality based on virus-contaminated water usage in developing countries: A review[J]. Environmental Research, 2021, 192: 110309.
.png)
